
A.一定无Na2CO3,可能有MgCl2
B.一定有FeCl3,可能有NaCl
C.一定有MgCl2,可能有NaCl
D.一定有NaCl
C
解析:原样品溶于水形成无色溶液,可排除FeCl3与Na2CO3的存在。因Fe3+的溶液显黄色,Na2CO3存在时会与CaCl2反应形成CaCO3沉淀。假设原样品全部为CaCl2,则可形成AgCl沉淀的质量为:
CaCl2 — 2AgCl
111 2×143.5
11.1 g m(AgCl)
m(AgCl)=![]() =28.7 g<29.7 g(实际得到沉淀量)。这说明CaCl2样品中一定含有比CaCl2含氯质量分数更高的物质,即MgCl2(比较含氯量时,只要分析Ca、Mg的相对原子质量即可),但样品中是否含有含氯量较CaCl2低的NaCl(可转化成Na2Cl2比较)却不能确定。故正确答案为C项。
=28.7 g<29.7 g(实际得到沉淀量)。这说明CaCl2样品中一定含有比CaCl2含氯质量分数更高的物质,即MgCl2(比较含氯量时,只要分析Ca、Mg的相对原子质量即可),但样品中是否含有含氯量较CaCl2低的NaCl(可转化成Na2Cl2比较)却不能确定。故正确答案为C项。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
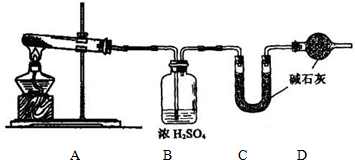 工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示: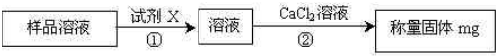
| 21m |
| 25w |
| 21m |
| 25w |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
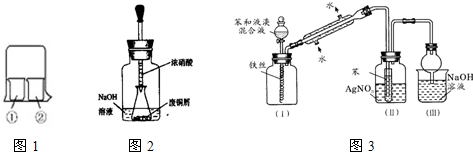
| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
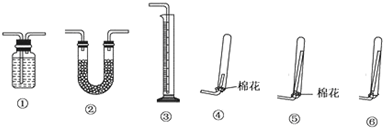
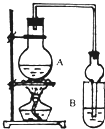 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com