
| A. | 甲烷、乙烯和苯在工业上都可以通过石油分馏得到 | |
| B. | 苯和乙烯都可使溴的四氯化碳溶液褪色 | |
| C. | 甲烷、乙烯、乙醇都能发生氧化反应 | |
| D. | 汽油、柴油属于烃,植物油属于高分子化合物 |
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置中阴极上析出红色固体 | |
| B. | 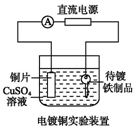 装置的待镀铁制品应与电源负极相连 | |
| C. | 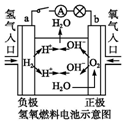 装置闭合电键后,外电路电子由a极流向b极 | |
| D. | 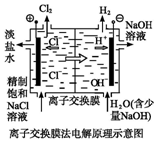 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
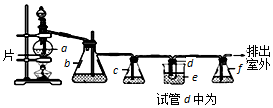
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯中是否混有乙酸,可以加石蕊试液进行检测 | |
| B. | 乙醇中是否混有乙酸,可以加入金属钠进行检验 | |
| C. | 乙酸乙酯、乙酸均能与NaOH反应,二者分子中的官能团相同 | |
| D. | 淀粉和蛋白质均可水解生成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①③④⑤ | C. | ①②③④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
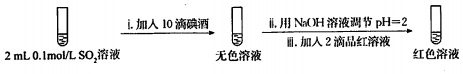
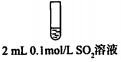
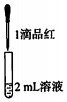 | 试管中的溶液 | 现象 |
| a.0.1mol/LSO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
| b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
| c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
| d.pH=10NaOH溶液 | 红色溶液不变色 | |
| e.pH=2H2SO4溶液 | 红色溶液不变色 |
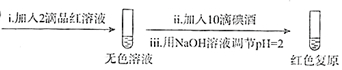
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AgCl、AgBr饱和溶液等体积混合后,滴加足量的硝酸银溶液,其主要沉淀物为AgBr | |
| B. | 常温下,浓度为0.1mol•L-1的HA溶液(Ka=10-5)pH≈3 | |
| C. | c(SO32-)相等的Na2SO3溶液、NaHSO3溶液、H2SO3溶液的浓度:c(NaHSO3)>c(H2SO3)>c(Na2SO3) | |
| D. | 25℃时,向10mL0.01mol•L-1KOH溶液中滴加10mL0.01mol•L-1的醋酸溶液后,混合液中:c(K+)>c(CH3COO-)>c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com