
| A、Fe3++3OH-═Fe(OH)3 |
| B、Zn+Cu2+═Zn2++Cu |
| C、2H2O2═2H2O+O2 |
| D、2H2S+SO2═3S+2H2O |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、向溴化银的浊液中加入溴化钠溶液,溴化银的Ksp减小 |
| B、向c点的溶液中加入0.1mol?L-1AgNO3,则c(Br-)减小 |
| C、升高温度可以实现c点到b点的转化 |
| D、图中b点对应的是不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3?H2O |
| B、NaOH |
| C、NiO |
| D、CaCO3浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| b |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
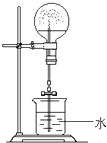 某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.
某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:
A、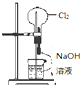 . .挤压胶头滴管后会看到烧瓶中形成喷泉 |
B、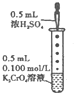 滴加几滴浓H2SO4后,溶液颜色由黄色变为橙色 |
C、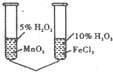 由该实验可以验证催化剂的催化效果 |
D、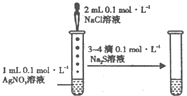 能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com