
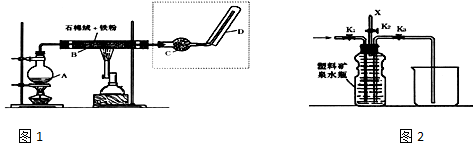
分析 (1)铁在高温下与水反应生成四氧化三铁和氢气;
(2)A的名称是圆底烧瓶;水的沸点为100℃,较低;
(3)根据铁和水蒸气的反应的反应物和生成物解答;
(4)可燃性的气体点燃前须验纯;当收集到半瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,须关闭K1,打开K2,连续轻轻排挤压塑料矿泉水瓶,使氢气缓缓逸出.
解答 解:(1)铁在高温下与水反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 ,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 ;
(2)A的名称是圆底烧瓶;水的沸点为100℃,较低,反应前A中投放碎瓷片的目的是防止A中水暴沸,
故答案为:圆底烧瓶;防止A中液体暴沸;
(3)铁和水蒸气反应,产物为四氧化三铁和氢气,当实验时,B中灰色的铁粉变为黑色,黑色固体中可能含有过量的铁,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液.溶液颜色无明显变化,说明在溶液中Fe3+被未反应的铁粉完全还原,离子反应方程式为:Fe+2Fe3+=3Fe2+;
故答案为:Fe+2Fe3+=3Fe2+;
(4)实验开始时,打开K1.K2,关闭K3,使反应先进行一段时间之后,在X口点燃收集到的气体,不纯的氢气在点燃时会有爆鸣声,爆鸣声说明有氢气生成,即可说明“铁与水蒸气”能够进行反应,可燃性的气体点燃前须验纯;当收集到半瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,须关闭K1,打开K2,连续轻轻排挤压塑料矿泉水瓶,使氢气缓缓逸出,
故答案为:氢气的验纯;关闭K1,打开K2.
点评 本题考查铁及其化合物的性质实验,结合相关的化学反应原理是解答的关键,本题难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 | ⑦ | ③ | ||
| 实验结论 | ⑥ | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( )
向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( )| A. | OA段产生的是NO和H2的混合气 | B. | BC段产生的全部是NO | ||
| C. | Fe2(SO4)3是最终的溶质 | D. | H2SO4的物质的量浓度是2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a≥2b,发生的反应化学方程式为:2C2H2+O2═4C+2H2O | |
| B. | 若($\frac{2}{5}$)b<a<($\frac{2}{3}$)b,燃烧后在密闭容器中加入含amolCa(OH)2的石灰水,发生反应的离子方程式为:OH-+CO2═HCO3- | |
| C. | 若a<($\frac{2}{5}$)b,燃烧过程中转移的电子的物质的量为10amol | |
| D. | 若a=($\frac{1}{2}$)b,燃烧产物既有CO2又有CO,且n(CO2):n(CO)=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com