
| A. | 因为H2O的沸点比H2S高,所以O原子得电子能力大于S原子 | |
| B. | 因为F原子得电子能力比Cl原子强,所以氢氟酸属于强酸 | |
| C. | 因为H2CO3酸性大于H2SiO3,所以CH4稳定性大于SiH4 | |
| D. | 因为Na+KCl(熔融)=NaCl+K↑,所以Na原子失电子能力大于K原子 |
分析 A.元素的非金属性越强,其得电子能力越强;
B.氢化物的酸性与原子得电子能力无关;
C.元素的非金属性越强,其最高价氧化物的水化物的酸性越强,其氢化物的稳定性越强;
D.钾的金属性大于Na,则K原子失电子能力大于Na原子.
解答 解:A.元素的非金属性越强,其得电子能力越强,氢化物的沸点与原子的得电子能力无关,故A错误;
B.氢化物的酸性与原子得电子能力无关,不能根据原子的得电子能力来判断酸性强弱,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物的酸性越强,其氢化物的稳定性越强,H2CO3酸性大于H2SiO3,则C的非金属性大于Si,所以CH4稳定性大于SiH4,故C正确;
D.钾的金属性大于Na,则K原子失电子能力大于Na原子,Na+KCl(熔融)=NaCl+K↑,该反应的发生与化学平衡移动有关,故D错误.
故选C.
点评 本题考查了元素非金属性、金属性的判断方法,题目难度不大,注意把握元素周期律的有关内容.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | K层 | B. | L层 | C. | M层 | D. | N层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和湿润的C12都有漂白性,推出二者混合后漂白性更强 | |
| B. | H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO | |
| C. | Na2O、Na2 O2组成元素相同,推出与水反应产物也完全相同 | |
| D. | CuCl2溶液与H2S可以生成CuS沉淀,推出FeCl2溶液也可与H2S生成FeS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝酸工业产生的尾气以及汽车排放出的尾气中含有氮氧化物(NOx).
硝酸工业产生的尾气以及汽车排放出的尾气中含有氮氧化物(NOx).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法.所用装置如图.
实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法.所用装置如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 证明溴乙烷中溴元素的存在:向溴乙烷中加入NaOH溶液,共热,冷却后加入AgNO3溶液,产生浅黄色沉淀 | |
| B. | 银氨溶液的配制:向1mL 2%的稀氨水中逐滴滴加2%的AgNO3溶液 | |
| C. | 苯甲酸的提纯:将1g粗苯甲酸放到100mL的烧杯里,加入50mL水,加热完全溶解后趁热过滤,静置冷却可析出苯甲酸晶体 | |
| D. | 除去苯中的苯酚杂质:向混有苯酚的苯中加入浓溴水,产生白色沉淀,再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.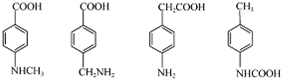 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A. | W点所示的溶液中:c (Na+)+c (H+)=2c (CO32-)+c (OH-)+c (Cl-) | |
| B. | pH=4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol•L-1 | |
| C. | pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)=c (OH-)+c (Cl- ) | |
| D. | pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32-)>c (HCO3-)>c (H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com