
(共8分)在恒温恒容的密闭容器中通入1mol N2和Xmol H2发生如下反应:N2+3H2 2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
(1)起始时充入H2的物质的量为 mol,氢气的转化率为 ;
(2)该反应的热化学方程式为 ;
(3)若起始时加入N2、H2、NH3的物质的量分别为a、b、c,达到平衡时各组分物质的量与上述平衡相同。若维持反应向正方向进行,则起始时c的取值范围是 。
(1)3 20%
(2)N2(g)+3H2(g)  2NH3(g) ΔH=-92.0kJ/mol (3) 0 mol≤c<0.4mol
2NH3(g) ΔH=-92.0kJ/mol (3) 0 mol≤c<0.4mol
【解析】(1)因为压强之比是物质的量之比,所以反应前气体的物质的量是3.6mol÷0.9=4.0mol,因此氢气的物质的量是4mol-1mol=3mol。设消耗氮气的物质的量是amol,则消耗氢气是3amol,生成氨气是2amol,因此有1.0mol-amol+3.0mol-3amol+2amol=3.6mol,解得a=0.2mol,所以氢气的转化率是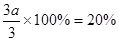 。
。
(2)由(1)可知消耗0.2mol氮气,放出的热量是18.4kJ,因此消耗1mol氮气放出的热量就是18.4kJ×5=92.0kJ,所以热化学方程式为N2(g)+3H2(g)  2NH3(g)
ΔH=-92.0kJ/mol。
2NH3(g)
ΔH=-92.0kJ/mol。
(3)根据(1)可知,平衡时生成氨气是0.4mol,所以要使反应向正方向进行,则起始时c的取值范围是0 mol≤c<0.4mol。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源:2011-2012学年重庆市杨家坪中学高一下学期期中考试化学试卷(带解析) 题型:填空题
(共8分)在恒温恒容的密闭容器中通入1mol N2和Xmol H2发生如下反应:N2+3H2 2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
(1)起始时充入H2的物质的量为 mol,氢气的转化率为 ;
(2)该反应的热化学方程式为 ;
(3)若起始时加入N2、H2、NH3的物质的量分别为a、b、c,达到平衡时各组分物质的量与上述平衡相同。若维持反应向正方向进行,则起始时c的取值范围是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省南昌市第二中学高二第一次月考化学试卷(带解析) 题型:计算题
(本题共12分)在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
| t c | 初始 | 2min | 4min | 6min | 8min |
| c(A)( mol·L -1) | 2.50 | 2.20 | 2.00 | 2.00 | 2.20 |
| c(B)( mol·L -1) | 1.56 | 2.16 | 2.56 | 2.56 | 2.16 |
| c(C)( mol·L -1) | 0.39 | 0.54 | 0.64 | 0.64 | 1.54 |
查看答案和解析>>
科目:高中化学 来源:2014届江西省南昌市高二第一次月考化学试卷(解析版) 题型:计算题
(本题共12分)在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
|
t c |
初始 |
2min |
4min |
6min |
8min |
|
c(A)( mol·L -1) |
2.50 |
2.20 |
2.00 |
2.00 |
2.20 |
|
c(B)( mol·L -1) |
1.56 |
2.16 |
2.56 |
2.56 |
2.16 |
|
c(C)( mol·L -1) |
0.39 |
0.54 |
0.64 |
0.64 |
1.54 |
请填空:
(1)前2mim内,v(B)= 。
(2) 到2mim末A 的转化率为 。
(3)该反应的化学方程式为 。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为 (填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为 mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则 是原来的2倍。
a. A的转化率 b. B的平衡浓度 表 c.达到平衡的时间 d.平衡时气体的密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com