
【题目】氧化镍为绿色粉末状固体,可用作搪瓷的密着剂和着色剂,陶瓷和玻璃的颜料。也可用作电子元件材料、催化剂和蓄电池材料。工业上可通过下列两种方法制取
NiCO3![]() NiO+CO2↑ Ni(NO3)2·6H2O
NiO+CO2↑ Ni(NO3)2·6H2O ![]() NiO+2HNO3+4H2O。
NiO+2HNO3+4H2O。
回答下列问题
(1)镍元素在元素周期表中的位置为__________,其价电子轨道表达式为____________________。
(2)上述两个反应涉及的非金属元素中第一电离能最大的元素为_________。其原子核外未成对电子数是__________。
(3)上述两个反应生成的非金属氧化物沸点较高的是_______,其主要原因是_________________。
(4)NO3-离子的空间构型是___________,其中心原子的杂化方式为___________。
(5)氧化镍晶体结构与氯化钠相似,其晶胞结构如下图,结构中氧离子采用面心立方最密堆积,镍离子的堆积方式是______________。

(6)纳米材料的表面原子占总原子数的比例极大,这是它有许多特殊性质的原因,假设某氧化镍纳米粒子的形状为立方体,其边长是氧化镍晶胞(如右图)的5倍,这种纳米颗粒的表面原子与总原子数的比为__________。
【答案】 第四周期,第Ⅷ族 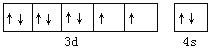 N 3 H2O 水分子间存在氢键 平面三角形 sp2 面心立方密堆积
N 3 H2O 水分子间存在氢键 平面三角形 sp2 面心立方密堆积 ![]() (或0.452或1:2.21)
(或0.452或1:2.21)
【解析】(1)镍元素核电荷数为28,基在元素周期表中的位置为第四周期第Ⅷ族,其基态原子电子排布式为[Ar]3d83s2,则价电子轨道表达式为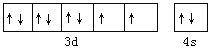 ;
;
(2)上述两个反应涉及的非金属元素有C、N、O,为周期三种元素,其第一电离能呈递增趋势,其中N元素的3p轨道为半充满结构,第一电离能相对较大,故第一电离能最大的元素为N,其原子核外未成对电子数是3;
(3)CO2和H2O均为分子晶体,其中沸点较高的是H2O,是因水分子间存在氢键的缘故;
(4)NO3-中N原子的价层电子对数为![]() =3,没有孤电子对,所以NO3-的空间构型为平面三角形,N原子杂化轨道形式为sp2;
=3,没有孤电子对,所以NO3-的空间构型为平面三角形,N原子杂化轨道形式为sp2;
(5)由晶胞结构可结构中氧离子采用面心立方最密堆积,镍离子的堆积方式也是 面心立方密堆积;
(6)氧化镍颗粒边长为晶胞边长的5倍,则每条边含有的原子数为11个,则总原子数为11的立方,表面原子总数为总原子数减去内部总原子数,内部原子总数相当于剥掉了一层晶胞,即颗粒内部每条边有9个原子,则内部原子总是为9的立方,纳米颗粒的表面原子与总原子数的比为![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列关于同分异构体判断正确的是( )
A.分子式为C3H6Cl2的同分异构体有四种
B.分子式为C8H10的芳香烃有3个,分别为 、
、 和
和![]()
C.分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3
D.二氯甲烷有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q五种元素的原子序数依次增大且分别位于周期表的二、三、四周期,X和Y的原子序数相差1,基态Y原子中有3个未成对电子:基态Z2-与基态W+的电子层结构相同,W为前四周期电负性最小的元素;Q位于周期表的第12列。
请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________形象化描述。
(2)基态X 原子的价层电子排布图为____________。基态W原子中有___________对自旋方向相反的电子。
(3)基态Y原子和基态Z原子的第一电离能:Y___________(填“>”或“<")Z。
(4)Fe3+常用X、Y、Z、W组成的一种化合物检验。与该化合物中的阴离子互为等电子体的—种分子为__________(填分子式)。
(5)Y的最高价含氧酸分子中,中心原子的杂化轨道类型为__________;其酸根离子的空间构型为______。
(6)相同压强下,Y的最简单氢化物的熔点低于W的氢化物的熔点,原因为_______________。
(7)Z与Q形成的一种晶体的晶胞如图所示,Z的配位数为_____________。若晶体密度为ρg·cm-1,阿伏加德罗常数的值为NA,则晶胞参数为____________nm(用含ρ、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用涉及氧化还原反应的是( )
A. 纯碱用于制造玻璃
B. 工业上利用合成氨实现人工固氮
C. 打磨磁石制指南针
D. 医疗上用小苏打治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某品牌的家用消毒剂其有效成分对氯间二甲苯酚(结构简式如下图所示),可以杀灭常见的病毒与细菌。下面有关物质的说法正确的是

A. 该物质的分子式是C8H10ClO
B. 1mol该物质最多可以与2mol NaOH反应
C. 1mol该物质可以与2mol液溴发生取代反应
D. 该物质可以发生加成、取代、消去、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验

(1)A装置的试管中发生反应的化学方程式是_____________________;F装置的烧杯中发生反应的离子方程式是__________________________;B装置中的现象是_________。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是______________ 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是_________________。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子,需将溶液稀释,操作方法是________________________________。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4 ![]() cCu2S+dCuSO4+e H2O,则a:b=______________。
cCu2S+dCuSO4+e H2O,则a:b=______________。
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00mL 0.30molL﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为6.4g,则硫酸铜的产率为_________________。(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣) 【注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值】
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com