
| A. | Na2CO3溶液中:2c(H2CO3)+c(HCO3-)+c(H+)=c(OH-) | |
| B. | 该沉淀转化反应的平衡常数约为25 | |
| C. | 约有0.04 mol BaSO4溶解 | |
| D. | 反应后溶液中:c(Na+)>c (CO32-)>c(SO42-)>c(Ba2+) |
分析 A.根据碳酸钠溶液中的质子守恒判断;
B.根据K=$\frac{{K}_{sp}(BaS{O}_{4})}{{K}_{sp}(BaC{O}_{3})}$及碳酸钡、硫酸钡的溶度积计算该沉淀转化反应的平衡常数;
C.设出溶解的硫酸钡的物质的量,根据沉淀转化平衡常数列式计算;
D.根据溶解的硫酸钡的物质的量计算出溶液中各离子的浓度,然后判断各离子浓度大小.
解答 解:A.根据碳酸钠溶液中的质子守恒可知:2c(H2CO3)+c(HCO3-)+c(H+)=c(OH-),故A正确;
B.BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)的转化反应的平衡常数为:K=$\frac{{K}_{sp}(BaS{O}_{4})}{{K}_{sp}(BaC{O}_{3})}$=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{1×1{0}^{-10}}{2.5×1{0}^{-9}}$=0.04,故B错误;
C.设溶解的硫酸钡的物质的量为x,则消耗的碳酸根离子的浓度为xmol/L,达到平衡时溶液中碳酸根离子的物质的量浓度为1-x,
则:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)
始态/mol•L-1 1 0
沉淀溶解平衡时/mol•L-1 1-x x
则:$\frac{x}{1-x}$=0.04,解得:x≈0.04,即约有0.04 mol BaSO4溶解,故C正确;
D.反应后的溶液中有:c(Na+)=2.0 mol•L-1,c(CO32-)≈1.0 mol•L-1-4×10-2 mol•L-1,c(SO42-)≈4×10-2 mol•L-1,c(Ba2+)≈2.5×10-9,故c(Na+)>c (CO32-)>c(SO42-)>c(Ba2+),故D正确;
故选B.
点评 本题考查了难溶物溶解平衡及其计算,题目难度中等,明确难溶物溶度积的含义为解答关键,注意掌握关键溶度积进行计算的方法,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | AgI悬浊液中存在平衡:AgI(s)?Ag+(aq)+I-(aq) | |
| B. | 25℃时,向AgCl的悬浊液中加入NaCl固体,AgCl的溶度积常数不变 | |
| C. | 向含KCl、NaI的混合溶液中滴入AgNO3溶液,一定先析出AgI沉淀 | |
| D. | 用等体积的水和氯化钠溶液分别洗涤AgCl沉淀,水洗造成的AgCl损耗大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
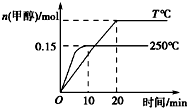 将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol,根据图示判断,下列结论正确的是( )
将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol,根据图示判断,下列结论正确的是( )| A. | a<0,T<250 | |
| B. | 250℃时,0~10 min内v(H2)=0.015 mol/(L•min) | |
| C. | CO的平衡转化率在250℃时比T℃时大 | |
| D. | 250℃时,起始时向容器中改充1 mol CH3OH气体,恒温达平衡后,CH3OH的物质的量大于0.15 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打是面包发酵粉的主要成分之一 | |
| B. | 盐类都可用作调味品 | |
| C. | 铝罐可久盛食醋 | |
| D. | 生石灰用作食品抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com