
【题目】已知:含C=C的物质(烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法不正确的是
![]()
A.D结构简式为CH3COOCH2CH3B.A能使酸性高锰酸钾溶液褪色
C.B与乙酸发生了取代反应D.可用B萃取碘水中的碘单质
【答案】D
【解析】
A是乙烯CH2=CH2,它和水在一定条件下发生加成反应得到B:乙醇CH3CH2OH;
乙醇与CuO在加热时发生反应得到C:乙醛CH3CHO;
乙醛与氧气在催化剂存在时被氧化得到乙酸:CH3COOH;
乙酸与乙醇在浓硫酸作用下发生酯化反应(即取代反应)得到D:乙酸乙酯CH3COOCH2CH3和水。
A选项,D为乙酸乙酯,其结构简式为CH3COOCH2CH3,故A正确;
B选项,乙烯CH2=CH2既能时溴水褪色,也能使酸性高锰酸钾溶液褪色,故B正确;
C选项,乙醇和乙酸发生酯化反应也叫取代反应,故C正确;
D选项,由于乙醇与水互溶,所以碘水中含有的碘单质不能以乙醇作萃取剂,故D错误;
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】煤、氢气是常见能源,燃煤烟气中的氮硫氧化物要污染环境,氢气是一种清洁高效的新型能源,如何消除烟气中氮硫氧化物和经济实用的制取氢气成为重要课题。
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如图。
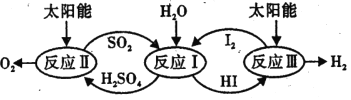
已知:
反应 I:2H2O (1)=2 H2(g) +O2(g) △H1 = +572kJmol-1
反应 II :H2SO4(aq) =SO2 (g) + H2O (l) +![]() O2 ( g) △H2= +327 kJ mol-1
O2 ( g) △H2= +327 kJ mol-1
反应 III:2 HI( aq)=H2 ( g) + I2(g) △H3 =+172k.Jmol-1
则反应SO2 (g)+I2 (g) + 2 H2O (l)=2 HI(aq) + H2SO4 (aq) △H =__________。
(2)用某氢化物 H2 R 高效制取氢气 ,发生的反应为2 H2R(g) ![]() R2(g) +2H2 ( g) 。
R2(g) +2H2 ( g) 。
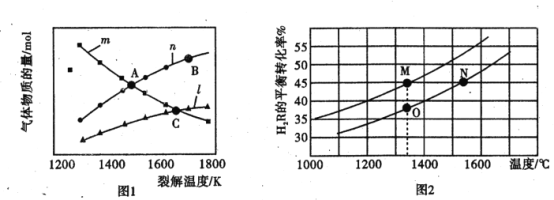
I.若起始时容器中只有H2R, 平衡时三种物质的物质的量与裂解温度的关系如图1。
①图中曲线n 表示的物质是__________(填化学式)。
②C点时,设容器内的总压为p Pa,则平衡常数KP =____________ (用平衡分压代替平衡浓度计算,分压 =总压×物质的量分数)。
II.若在两个等体积的恒容容器中分别加入2.0 mol H 2R、1. 0 molH2R,测得不同温度H2R的平衡转化率如图2 所示。
①M点和O正反应速率v( M) ________v( O) (填“>”“<”或“=”,下同)。
②M 、O 两点容器内的压强P(O)______2 P( M) 。
③平衡常数K( M)_____________K( N)。
(3)以连二硫酸根( S2O42-) 为媒介,使用间接电化学法处理燃煤烟气中的NO, 装置如图所示:
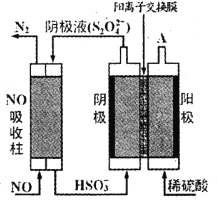
①从 A 口中出来的物质是________________。
②写出电解池阴极的电极反应式________________。
③用离子方程式表示吸收池中除去NO 的原理 ___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 该反应的ΔS<0、ΔH<0
B. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·S-1
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L的密闭容器中,气体X、Y、Z的物质的量随时间的变化曲线如图所示。
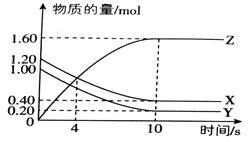
(1)该反应的化学方程式为_________________________.
(2)0~10s内,X的化学反应速率为___________________.
(3)该反应在不同温度下的平衡常数如表所示:
T/℃ | 100 | 220 | 830 | 1000 | 1200 |
K | 45.00 | 32.00 | 1.00 | 0.60 | 0.38 |
则该反应的ΔH__________0 (填“>”、“<”或“=”)
(4)830℃时,在容积为10L的恒容密闭容器中充入5molX气体、7.8molY气体和7.1mol Z气体,此时υ(正)_______υ(逆) (填“>”、“<”或“=”)
(5)上图所示反应的温度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照《能源发展“十三五”规划》的要求,到2020年,中国煤炭消费总量控制在41亿吨以内,所占比重应减少到58%。推进煤炭清洁高效利用是我国能源发展重要举措之一。![]() 在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述不正确的是( )
在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述不正确的是( )
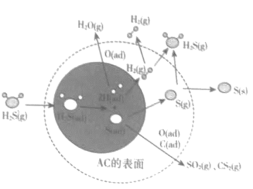
A.图中阴影部分为![]() 的解离过程
的解离过程
B.图中既有O-H键的形成也有O-H键的断裂
C.![]() 在AC表面的去除率与温度有关
在AC表面的去除率与温度有关
D.![]() 在AC表面作用生成的产物有
在AC表面作用生成的产物有![]() 等
等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mLAl2(SO4)3溶液中,含有Al3+为1.62 克,在该溶液中加入0.1mol/LBa(OH)2溶夜300ml,反应后溶液中SO42-的物质的量浓度约为
A. 0.4 mol/L B. 0.3 mol/L C. 0.1 mol/L D. 0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯,并验证乙烯的性质。完成下列填空:
(1)实验室制取乙烯的化学方程式为:________________________________________
(2)可用于制取乙烯的发生装置是____________。(选填编号)
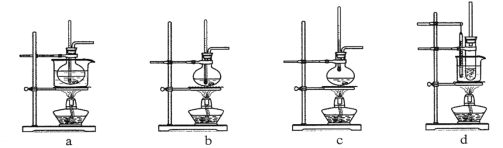
(3)反应液加入碎瓷片的目的是:_______________________。
(4)制得的乙烯中常含有SO2和CO2 ,设计实验证明乙烯能使溴水褪色。(画出装置图)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为___。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6kJ·mol-1
2SO3(g) ΔH1=﹣196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJ·mol-1
2NO2(g) ΔH2=﹣113.0kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=___kJ·mol-1。
SO3(g)+NO(g)的ΔH=___kJ·mol-1。
(3)一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___(填字母)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将___(填“增大”“减小”或“不变”)
(4)已知N2O4(g)![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___。
A.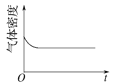 B.
B.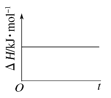 C.
C.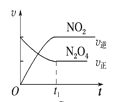 D.
D.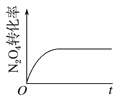
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com