
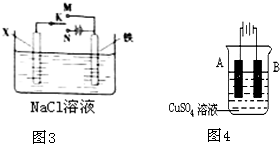
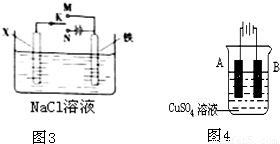
如图-3所示,将铁棒和石墨棒擦入l L l mol·L-1食盐水中。
下列说法正确的是 ( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是
4OH-—4e-=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现
铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)
气体时,生成了1 mol NaOH
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
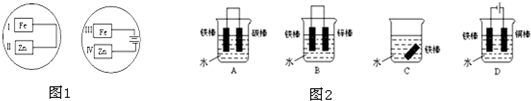
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
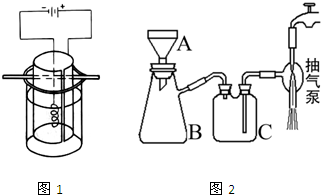 高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程:
高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
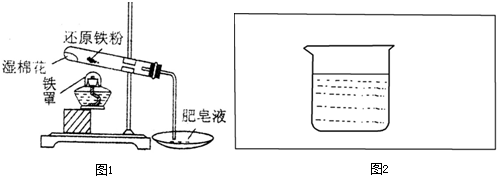
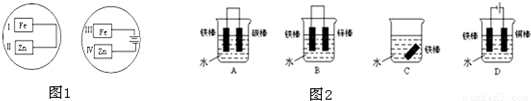
 ”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).
”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省莆田市城厢区哲理中学高二(上)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com