
| Fe2O3 | CO | Fe | CO21 | |
| ¼×/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ŅŅ/mol | 1.0 | 2.0 | 1.0 | 1.0 |
·ÖĪö £Ø1£©¢ŁFe2O3£Øs£©+3C£ØŹÆÄ«£©=2Fe£Øs£©+3CO£Øg£©”÷H1=+489.0kJmol-1
¢ŚC£ØŹÆÄ«£©+CO2£Øg£©=2CO£Øg£©”÷H2=+172.5kJmol-1
ÓÉøĒĖ¹¶ØĀÉ¢Ł-¢Ś”Į3µĆµ½Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©£»
£Ø2£©KĪŖÉś³ÉĪļÅضČĆŻÖ®»żÓė·“Ó¦ĪļÅضČĆŻÖ®»żµÄ±Č£¬·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ÉżĪĀĘ½ŗāÄęĻņ½ųŠŠ£»
£Ø3£©¢ŁŌŚT”ꏱ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=64£¬ŌŚ2LŗćČŻĆܱÕČŻĘ÷¼×ÖŠ£¬¼ÓČėĪļÖŹ·“Ó¦“ļµ½Ę½ŗā£¬ÉčĻūŗÄŅ»Ńõ»ÆĢ¼ĪļÖŹµÄĮæĪŖx
Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©
ĘšŹ¼Įæ£Ømol£© 1 1 1 1
±ä»ÆĮæ£Ømol£© x x
Ę½ŗāĮæ£Ømol£© 1-x 1+x
K=$\frac{£Ø1+x£©^{3}}{£Ø1-x£©^{3}}$=64£¬½āµĆx=0.6£¬ŅŌ“Ė¼ĘĖć×Ŗ»ÆĀŹ£»
¢Śa£®·“Ó¦Ē°ŗóĘųĢåÖŹĮæ±ä»Æ£¬Ģå»ż²»±ä£¬ĘųĢåĆܶČĪŖ±äĮ棻
b£®·“Ó¦Ē°ŗóĘųĢåĢå»żĻąĶ¬£¬ĖłŅŌŌö¼Ó·“Ó¦ĪļµÄĪļÖŹµÄĮ棬µČĶ¬ÓŚ¼ÓŃ¹£¬Ę½ŗā²»ŅĘ¶Æ£»
c£®¼×ČŻĘ÷ÖŠĘ½ŗāŅ»Ńõ»ÆĢ¼ĪļÖŹµÄĮæĪŖ0.4mol£»ŅŅČŻĘ÷ÖŠ½įŗĻĘ½ŗā³£ŹżæÉÖŖĻūŗÄŅ»Ńõ»ÆĢ¼ĪŖ1.4mol£¬Ę½ŗāĪļÖŹµÄĮæĪŖ0.6mol£»
d£®¹ĢĢåĮæŌö¼Ó²»Ó°Ļģ»ÆŃ§Ę½ŗā£»
£Ø4£©¢ŁŌµē³ŲÖŠÕż¼«±»±£»¤£¬µē½ā³ŲÖŠŅõ¼«±»±£»¤£»
¢Ś±£»¤Ģś£¬ŌņČĆĢś×öŌµē³ŲµÄÕż¼«£¬XĪŖ±ČĢś»īĘĆµÄ½šŹō£®
½ā“š ½ā£ŗ£Ø1£©¢ŁFe2O3£Øs£©+3C£ØŹÆÄ«£©=2Fe£Øs£©+3CO£Øg£©”÷H1=+489.0kJmol-1
¢ŚC£ØŹÆÄ«£©+CO2£Øg£©=2CO£Øg£©”÷H2=+172.5kJmol-1
ÓÉøĒĖ¹¶ØĀÉ¢Ł-¢Ś”Į3µĆµ½Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©”÷H=£Ø+489.0kJmol-1£©-£Ø+172.5kJmol-1£©”Į3=-28.5kJmol-1£¬
¹Ź“š°øĪŖ£ŗ-28.5£»
£Ø2£©Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©”÷H=-28.5kJmol-1£¬Ę½ŗā³£ŹżK=$\frac{{c}^{3}£ØC{O}_{2}£©}{{c}^{3}£ØCO£©}$£¬·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ÉżĪĀĘ½ŗāÄęĻņ½ųŠŠ£¬Ę½ŗā³£Źż¼õŠ”£¬
¹Ź“š°øĪŖ£ŗ$\frac{{c}^{3}£ØC{O}_{2}£©}{{c}^{3}£ØCO£©}$£»¼õŠ”£»
£Ø3£©¢ŁŌŚT”ꏱ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=64£¬ŌŚ2LŗćČŻĆܱÕČŻĘ÷¼×ÖŠ£¬¼ÓČėĪļÖŹ·“Ó¦“ļµ½Ę½ŗā£¬ÉčĻūŗÄŅ»Ńõ»ÆĢ¼ĪļÖŹµÄĮæĪŖx
Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©
ĘšŹ¼Įæ£Ømol£© 1 1 1 1
±ä»ÆĮæ£Ømol£© x x
Ę½ŗāĮæ£Ømol£© 1-x 1+x
K=$\frac{£Ø1+x£©^{3}}{£Ø1-x£©^{3}}$=64£¬½āµĆx=0.6£¬×Ŗ»ÆĀŹĪŖ$\frac{0.6}{1}$”Į100%=60%£¬
¹Ź“š°øĪŖ£ŗ60%£»
¢Śa£®·“Ó¦Ē°ŗóĘųĢåÖŹĮæ±ä»Æ£¬Ģå»ż²»±ä£¬ČōČŻĘ÷ÄŚĘųĢåĆܶČŗć¶ØŹ±£¬±źÖ¾·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬¹ŹaÕżČ·£»
b£®·“Ó¦Ē°ŗóĘųĢåĢå»żĻąĶ¬£¬ĖłŅŌŌö¼Ó·“Ó¦ĪļµÄĪļÖŹµÄĮ棬µČĶ¬ÓŚ¼ÓŃ¹£¬Ę½ŗā²»ŅĘ¶Æ£¬Ę½ŗā×Ŗ»ÆĀŹĻąĶ¬£¬¹Ź“ķĪó£»
c£®¼×ČŻĘ÷ÖŠĘ½ŗāŅ»Ńõ»ÆĢ¼ĪļÖŹµÄĮæĪŖ0.4mol£»ŅŅČŻĘ÷ÖŠ½įŗĻĘ½ŗā³£Źż¼ĘĖćµĆµ½ĻūŗÄŅ»Ńõ»ÆĢ¼ĪŖ1.4mol£¬Ę½ŗāĪļÖŹµÄĮæĪŖ0.6mol£¬¼×ŗĶŅŅČŻĘ÷ÖŠCOµÄĘ½ŗāÅضČÖ®±ČĪŖ0.4+0.6=2£ŗ3£¬¹ŹÕżČ·£»
d£®¹ĢĢåĮæŌö¼Ó²»Ó°Ļģ»ÆŃ§Ę½ŗā£¬Ōö¼ÓFe2O3²»ÄÜĢįøßCOµÄ×Ŗ»ÆĀŹ£¬¹Ź“ķĪó£»
¹Ź“š°øĪŖ£ŗac£»
£Ø4£©¢Ła”¢Ģś×öŃō¼«£¬Ź§Č„µē×Ó£¬¹ŹĆ»ÓŠ±»±£»¤£»b”¢Ģś×öŅõ¼«£¬±»±£»¤£»c”¢Ģś×öÕż¼«£¬±»±£»¤£»¹ŹŃ”bc£»
¢Ś±£»¤Ģś£¬ŌņČĆĢś×öŌµē³ŲµÄÕż¼«£¬X»ī¶ÆŠŌ±ČĢśĒ棬æÉŅŌĪŖŠæ£¬¹Ź“š°øĪŖ£ŗŠæ£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕ»ÆŃ§Ę½ŗāČż¶Ī·Ø”¢×Ŗ»ÆĀŹ¼ĘĖć”¢µē»ÆѧӦÓĆ”¢øĒĖ¹¶ØĀÉÓ¦ÓĆĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬×ŪŗĻŠŌ½ĻĒ棬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£®22.4LĖ®ŗ¬ÓŠNAøöĖ®·Ö×Ó | |
| B£® | 1mol/LNa2C03ČÜŅŗÖŠŗ¬ÓŠNa+ŹżÄæĪŖ2NA | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ£¬22.4L02ÖŠŗ¬ÓŠ2NAøöŃõŌ×Ó | |
| D£® | 169O2ŗĶO3µÄ»ģŗĻĘųĢåÖŠŗ¬ŃõŌ×ÓŹżÄæĪŖNA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H1 | B£® | C£Øs£©+$\frac{1}{2}$O2£Øg£©=CO£Øg£©”÷H2 | ||
| C£® | HCl£Øaq£©+NaOH£Øaq£©=NaCl£Øaq£©+H2O£Ø l £©”÷H3 | D£® | C6H12O6£Øs£©+6O2£Øg£©=6CO2£Øg£©+6H2O£Ø l £©”÷H4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
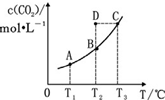 ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠ“ęŌŚĻĀĮŠĘ½ŗā£ŗCO£Øg£©+H2O£Øg£©?CO2£Øg£©+H2£Øg£©£®CO2£Øg£©µÄĘ½ŗāĪļÖŹµÄĮæÅØ¶Č c£ØCO2£©ÓėĪĀ¶Č T µÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©
ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠ“ęŌŚĻĀĮŠĘ½ŗā£ŗCO£Øg£©+H2O£Øg£©?CO2£Øg£©+H2£Øg£©£®CO2£Øg£©µÄĘ½ŗāĪļÖŹµÄĮæÅØ¶Č c£ØCO2£©ÓėĪĀ¶Č T µÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©| A£® | ·“Ó¦ CO£Øg£©+H2O£Øg£©?CO2£Øg£©+H2£Øg£©µÄ”÷H£¾0 | |
| B£® | ŌŚ T2Ź±£¬Čō·“Ó¦“¦ÓŚ×“Ģ¬ D£¬ŌņÓŠ v Õż£¼v Äę | |
| C£® | Ę½ŗāדĢ¬ A Óė C Ļą±Č£¬Ę½ŗāדĢ¬ A µÄ c£ØCO£©Š” | |
| D£® | Čō T1”¢T2Ź±µÄĘ½ŗā³£Źż·Ö±šĪŖ K1”¢K2£¬Ōņ K1£¼K2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2.4 g½šŹōĆ¾±äĪŖĆ¾Ąė×ÓŹ±Ź§Č„µÄµē×ÓŹżĪŖ0.1NA | |
| B£® | 1 mol HClĘųĢåÖŠµÄĮ£×ÓŹżÓė0.5 mol/LŃĪĖįÖŠČÜÖŹĮ£×ÓŹżĻąµČ | |
| C£® | ŌŚ±ź×¼×“æöĻĀ£¬22.4 L CH4Óė18 g H2OĖłŗ¬ÓŠµē×ÓŹż¾łĪŖ10NA | |
| D£® | COŗĶN2ĪŖµČµē×ÓĢ壬22.4 LµÄCOĘųĢåÓė1 mol N2Ėłŗ¬µÄµē×ÓŹżĻąµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ł¶¾ | B£® | ÅĢÄįĪ÷ĮÖ | C£® | ŗ£ĀåŅņ | D£® | Āš·Č |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚ16g18O2ÖŠŗ¬ÓŠNAøöŃõŌ×Ó | |
| B£® | ±ź×¼×“æöĻĀ£¬22.4LæÕĘųŗ¬ÓŠNAøöµ„ÖŹ·Ö×Ó | |
| C£® | 1 mol•L-1µÄNaClO ČÜŅŗÖŠŗ¬ÓŠClO-µÄŹżÄæÉŁÓŚNAøö | |
| D£® | 12gMgŌŚæÕĘųÖŠĶźČ«Č¼ÉÕÉś³ÉMgOŗĶMg3N2£¬×ŖŅʵĵē×ÓŹżĪŖNA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 ŃĪĖįŗĶĒāŃõ»ÆÄĘŹĒ¹¤ŅµÉĻÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬Ņ²ŹĒŹµŃéŹŅĄļ³£¼ūµÄŹŌ¼Į£®
ŃĪĖįŗĶĒāŃõ»ÆÄĘŹĒ¹¤ŅµÉĻÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬Ņ²ŹĒŹµŃéŹŅĄļ³£¼ūµÄŹŌ¼Į£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com