
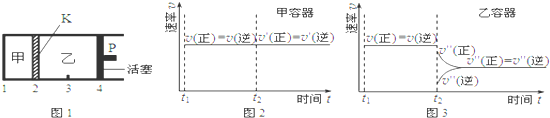
| A. | 保持活塞位置不变,降低温度,达到新的平衡后,甲、乙中B的体积分数均增大 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
分析 从等效平衡的角度分析,4molC和2molD相当于2molA和4molB,即乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态,在此基础上,从平衡移动的角度解答此题.
解答 解:从等效平衡的角度分析,4molC和2molD相当于2molA和4molB,即乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态,
A、保持活塞位置不变,降低两个容器的温度,平衡向正反应方向移动,甲、乙中B的体积分数都减小,故A错误;
B、保持温度和活塞位置不变,在甲中再加入1molA和2molB,则相当于在原来的基础上增大压强,平衡向逆反应方向移动,达到平衡时,甲中C的浓度小于原来的2倍,即小于乙中C的浓度的2倍,故B错误;
C、甲温度和体积变化,加入氦气后对平衡移动没有影响,保持温度和乙中的压强不变,加入氦气后乙体积增大,平衡应向正反应方向移动,正逆反应速率都减小,故C正确.
D、保持温度不变,移动活塞P,使乙的容积和甲相等,则乙容器内的压强增大,平衡向逆反应方向移动,达到新的平衡后,乙中C的体积分数小于甲中C的体积分数的2倍,故D错误;
故选C.
点评 本题考查化学平衡移动的影响因素,题目难度中等,注意从等效平衡的角度分析起始时甲乙两容器内的气体的平衡状态,在此基础上从平衡移动的角度分析.


科目:高中化学 来源: 题型:解答题
 3,3-二乙基戊烷;
3,3-二乙基戊烷; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CO32-)的大小关系为:②>⑤>③>④>① | |
| B. | 将溶液蒸干灼烧只有②能得到对应的固体物质 | |
| C. | ③④⑤既能与盐酸反应,又能与NaOH溶液反应 | |
| D. | c(HCO3-)的大小关系为:④>③>⑤>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
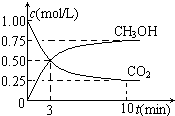 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
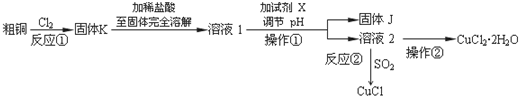
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入四氯化碳,操作振荡、静置, 现象CCl4层呈橙红色,水层呈无色 | 假设1正确 |
| ②向溶液中另入KSCN溶液, 现象溶液变为红色 | 假设2正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用敞开放置久了的浓硫酸进行配制 | B. | 量取浓硫酸仰视刻度线 | ||
| C. | 配制过程中未洗涤烧杯和玻璃棒 | D. | 配制前,容量瓶有少许蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应选用100mL容量瓶 | |
| B. | 配置之前容量瓶中残留的蒸馏水会导致浓度偏高 | |
| C. | 定容时腐蚀刻度会导致浓度偏低 | |
| D. | 摇匀、静置后发现凹液面低于刻度线,再加水至刻度线即可 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com