
【题目】已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图1。F元素的正三价离子3d能级为半充满。

(1)A的元素符号是___;E在元素周期表中的位置是__。
(2)B的氢化物的晶体类型是____晶体,B的氢化物与C的氢化物相比,分子极性较大的是__写化学式![]() 。
。
(3)D与B形成的化合物晶体的密度为ag·cm-3,则晶胞的体积是___![]() 只要求列出算式,D和B形成的化合物的M为78g/mol)。
只要求列出算式,D和B形成的化合物的M为78g/mol)。
(4)晶胞是晶体中最小的重复单元。已知F元素的单质为面心立方晶体,其结构如图甲所示,面心立方的结构特征如图乙所示。若F原子的半径为1.27×10-10m。试求该金属晶体中的晶胞边长,即图丙中AB的长度为__m。
【答案】H 第四周期第VIIB族 分子 HF ![]() 3.59×10-10
3.59×10-10
【解析】
根据题意,从D、E是周期表中![]() 列中E排第7列可判断E是第4周期VIIB族的Mn元素,原子序数为25,D和E属同一周期,所以D也在第4周期,D的原子序数比E小5,则原子序数为20,应为Ca元素,图中利用均摊法,离子化合物D与B的离子个数比值为
列中E排第7列可判断E是第4周期VIIB族的Mn元素,原子序数为25,D和E属同一周期,所以D也在第4周期,D的原子序数比E小5,则原子序数为20,应为Ca元素,图中利用均摊法,离子化合物D与B的离子个数比值为![]() :2,且D为Ca,则B的化合价为
:2,且D为Ca,则B的化合价为![]() 价,应为第ⅦA族元素,B和C属同一主族,B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H,据此分析解答。
价,应为第ⅦA族元素,B和C属同一主族,B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H,据此分析解答。
![]() 综上所述,A的元素符号为H,E是Mn元素;在周期表中第四周期VIIB族;
综上所述,A的元素符号为H,E是Mn元素;在周期表中第四周期VIIB族;
故答案为:H;第四周期第VIIB族;
![]() 为F元素,C为Cl元素,HF熔沸点很低,属于分子晶体;组成分子的元素电负性差别越大,分子的极性越大,F元素是电负性最大的元素,故HF的极性较大;
为F元素,C为Cl元素,HF熔沸点很低,属于分子晶体;组成分子的元素电负性差别越大,分子的极性越大,F元素是电负性最大的元素,故HF的极性较大;
故答案为:分子;HF;
![]() 根据
根据![]() ,根据上述均摊法,每个晶胞中Ca的数目为
,根据上述均摊法,每个晶胞中Ca的数目为![]() ,F原子数目为8个,即4个
,F原子数目为8个,即4个![]() ,所以
,所以![]() ;
;
故答案为:![]() ;
;
![]() 由图丙可知,设边长为a,
由图丙可知,设边长为a,![]() ,即
,即![]() ;
;
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)![]() 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
③H+(aq)+OH-(aq)![]() H2O(l) ΔH=-57.3 kJ·mol-1
H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. H2(g)的燃烧热为142.9 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)![]() 1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)![]() CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. ②中若生成固态硫,ΔH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积可变的400 ℃密闭容器中,一定量的SO2和O2在催化剂作用下发生反应:2SO2(g)+O2(g) 2SO3(g)+QkJ,下列叙述错误的是( )
2SO3(g)+QkJ,下列叙述错误的是( )
A.增大压强,正反应速率一直增大至不变,平衡正移
B.降低温度,正反应速率比逆反应速率减小的程度小
C.若将三氧化硫分离出,则平衡正向移动,平衡常数K值不变
D.若气体的物质的量减少0.5mol时达到平衡,则该条件下反应放出0.5QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x、y、z……表示)的原子半径相对大小、最高正价或最低负价的变化如下图所示。
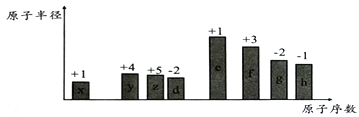
请回答下列问题:
(1)f在周期表中的位置为______________;x形成的阴离子的结构示意图为_____________________。
(2)比较d、e常见离子的半径大小:__________________(填化学式,下同);比较g、h的最高价氧化物对应水化物的酸性强弱:_______________________。
(3)x、y、z、d四种元素能形成多种化合物。
①能形成离子化合物,其中一种x、y、z、d四种原子的个数比为5∶2∶1 ∶4,其化学式为__________________________。
②能形成共价化合物,写出其中一种的结构简式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200KJ/mol,温度不同(T2>T1)其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种元素的原子序数之和等于36.A的单质是最轻的气体;B的基态原子有3个不同的能级,各能级中电子数相等;D有“生物金属”之称,其单质和化合物有广泛的用途,D4+离子和氩原子的核外电子排布相同.工业上利用DO2和碳酸钡在熔融状态下制取化合物甲(甲可看做一种含氧酸盐).化合物甲有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,化合物甲晶体的晶胞结构为立方体(如下图所示),其中Ba2+占据体心位置,O2-占据棱心位置,D4+占据顶点位置.
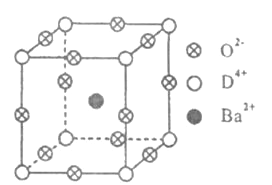
请回答下列问题:
(1)A、B、C三种元素的电负性由大到小的顺序是__________________(填元素符号).
(2)BA4分子的空间构型是______________;B原子轨道的杂化类型为_____.
(3)C的气态氢化物的电子式为____;其沸点高于同主族其他元素氢化物的沸点,主要原因是____________________.
(4)D的基态原子核外电子排布式为____________________.
(5)①制备化合物甲的化学方程式为____________________.
②在甲晶体中,若将D4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的__________.
③在甲晶体中,D4+的氧配位数为__________.
④已知甲晶体的摩尔质量为M g/mol,其晶胞边长为4.03×10-10m,则甲晶体的密度为__________________g/cm3(要求列出算式,阿伏加德罗常数用NA表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应: A(g)+xB(g)![]() 2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A. 平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B. x值等于3
C. A的转化率为20%
D. B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,.当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是( )
2C(g)+D(g)已达平衡状态的是( )
①气体的平均相对分子质量不再变化;②单位时间内生成amolA,同时消耗2amolC;③容器中的压强不再变化;④混合气体的密度不再变化;⑤B的浓度不再变化;⑥n(A):n(B):n(C):n(D)=1:3:2:2
A.②③⑤B.①③④⑥C.②④⑤D.②③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com