
利用反应Cu+2FeCl3===CuCl2+2FeCl2组成一个化学电池。
(1)指出正极为________,电极反应式为__________________________________;负极为____________,电极反应式为____________________________。
(2)若电池内溶液为100 mL 0.5 mol/L的FeCl3溶液;当溶液中FeCl3全部被还原成FeCl2时,溶液中CuCl2的物质的量浓度是________,导线上通过的电子是________mol。
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
核磁共振(NMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一个结构中的等性氢原子的1H—NMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的等性氢原子数成正比。现有某种有机物,通过元素分析得到的数据为C∶85.71%,H∶14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的分子式为____________。
(2)已知该物质可能存在多种结构,A、B、C是其中的三种,请根据下列要求填空:
①A是链状化合物与氢气加成产物分子中有三个甲基,则A的可能结构有________种(不考虑立体异构)。
②B是链状化合物,1H—NMR谱中只有一个信号,则B的结构简式为______________。
③C是环状化合物,1H—NMR谱中也只有一个信号,则C的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在浓H2SO4存在并加热至170℃的过程中,2个醇分子在羟基上可发生分子间脱水反应生成醚,如CH3CH2—OH+HO—CH2CH3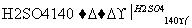 CH3CH2—O—CH2CH3+H2O
CH3CH2—O—CH2CH3+H2O
用浓H2SO4跟分子式分别为C2H6O和C3H8O的醇的混合液反应,可得到的有机物的种类有( )
A.2种 B.4种 C.6种 D.8种
查看答案和解析>>
科目:高中化学 来源: 题型:
某学校设计了一节实验活动课,让学生从废旧电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下。回答有关问题。
(1)干电池的基本构造和工作原理
如图为干电池的基本构造图。干电池工作时负极上的电极反应是
__________________________,MnO2的作用是除去正极上的产物H2,该反应方程式为2MnO2+H2===Mn2O3+H2O。
(2)锌皮和碳棒的回收
用钳子和剪子剪开待回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②设计简单的实验证明所得晶体中含有NH 。
。
实验步骤
________________________________________________________________________
________________________________________________________________________;
实验现象
________________________________________________________________________;
有关的离子方程式
________________________________________________________________________。
③用________的方法可将NH4Cl和ZnCl2的晶体混合物分离开。
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中要用到的主要仪器有
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
学在生产和日常生活中有着重要的应用。下列说法不正确的是(双选)( )
A.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-===4OH-
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.在海轮外壳上镶入锌块,锌作负极,可减缓船体的腐蚀速率
D.在空气中,铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是
A.氯化亚铁溶液中加入双氧水 B.硫酸铁溶液中滴加硫氰酸钾溶液
C.硫酸铜溶液中滴加硝酸钡溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
按如图所示装置进行铁和水蒸气反应的实验。
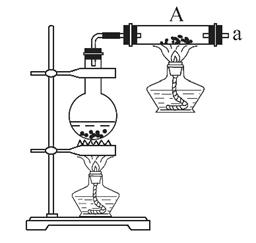
(1)铁粉与水蒸气反应的化学方程式是: ;
(2)为检验生成的气体产物,需从下图选择必要的装置,其正确的连接顺序为(用接口字母表示)a— ,描述能证明气体产物的实验现象_ ;

(3)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法: ;
(4)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(用化学方程式说明): ;
(5)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是: ;
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有同学设计如下图所示的装置: 通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
A.电源中的a为正极,b为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是( )
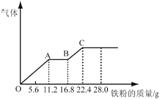 A.混合酸中HNO3物质的量浓度为2 mol·L-1
A.混合酸中HNO3物质的量浓度为2 mol·L-1
B.原混合酸中H2SO4物质的量为0.4 mol
C.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,
BC段产生氢气
D.第二份溶液中最终溶质为FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
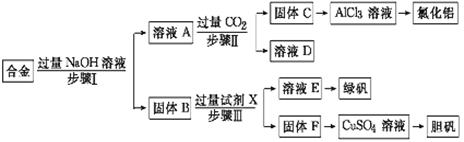
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
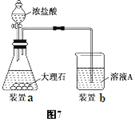
(3)进行步骤Ⅱ时,该小组用如图7所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式 ,请选出你认为的最佳途径并说明选择的理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com