
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| B. | 在0.1mol•L-1 的NaHA溶液pH=4,则H2A为强酸 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
分析 A.pH=11的NaOH溶液中c(NaOH)=0.001mol/L,pH=3的醋酸溶液中c(CH3COOH)>0.001mol/L,等体积混合,酸剩余;
B.在0.1mol•L-1 的NaHA溶液pH=4,溶液显酸性,可能说明HA-离子电离大于A-离子水解或H2A为强酸;
C.溶液中存在电荷守恒判断离子浓度大小,常温下,pH=7的NH4Cl与氨水的混合溶液c(H+)=c(OHˉ);
D.向氨水中加入硫酸铵,铵根离子浓度增大,抑制一水合氨电离.
解答 解:A.pH=11的NaOH溶液中c(NaOH)=0.001mol/L,pH=3的醋酸溶液中c(CH3COOH)>0.001mol/L,等体积混合,酸剩余,溶液呈酸性,酸能使石蕊试液呈红色,故A正确;
B.在0.1mol•L-1 的NaHA溶液pH=4,溶液显酸性,可能说明HA-离子电离大于A-离子水解或H2A为强酸,如NaHSO4溶液显酸性,NaHSO3溶液显酸性,H2A不一定为强酸,故B错误;
C.常温下,pH=7的NH4Cl与氨水的混合溶液c(H+)=c(OHˉ),溶液中存在电荷守恒,c(H+)+c(NH4+)=c(OH-)+c(Cl-),c(Cl-)=c(NH4+)>c(H+)=c(OH-),故C错误;
D.向氨水中加入硫酸铵固体,铵根离子浓度增大,抑制一水合氨电离,则溶液中氢氧根离子浓度减小,一水合氨分子浓度增大,所以溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,故D错误;
故选A.
点评 本题考查了酸碱混合溶液定性判断,根据电荷守恒、弱电解质电离平衡的影响因素等知识来分析解答,注意弱电解质电离程度与离子浓度的关系,题目难度中等.


科目:高中化学 来源: 题型:解答题
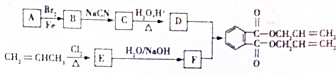
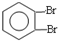 ,化合物E中所含的官能团名称为氯原子、碳碳双键.
,化合物E中所含的官能团名称为氯原子、碳碳双键.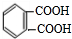 +2HOCH2CH=CH2$\stackrel{催化剂}{→}$
+2HOCH2CH=CH2$\stackrel{催化剂}{→}$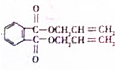 +2H2O,反应类型为酯化(取代)反应.
+2H2O,反应类型为酯化(取代)反应.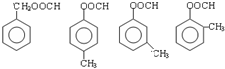 (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2和CO2都是污染性气体 | |
| B. | 熟石灰、铝热剂、盐酸都是混合物 | |
| C. | 煤的干馏、海水中提取碘的过程都包括化学变化 | |
| D. | A12O3、Cl2、CuSO4在熔融状态或溶于水时均能导电,都属电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gCO和N2混合气体中含有原子总数为2NA | |
| B. | 在1L1mol•L-1的氨水中含有NA个NH3分子 | |
| C. | 标准状况下,11.2LNO和11.2LO2混合后气体分子数为NA | |
| D. | 1mol Fe分别与足量Cl2、S反应,Fe失去电子数都为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胡粉中的Pb显+4价 | |
| B. | 这里的“火”中含有炭 | |
| C. | 此过程中可能发生了化合反应 | |
| D. | 在元素周期表中铅与炭都位于第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| B. | Na2O2与H2O反应生成1.12L(标况)氧气,反应中转移电子的电子数为0.1NA | |
| C. | 1molNa与足量氧气反应,失去的电子数目为NA | |
| D. | 78gNa2O2固体中阴离子个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液可以与福尔马林溶液混合使用 | |
| B. | NaClO的稳定性和漂白性都比HClO强 | |
| C. | 工业上在特定条件下电解饱和食盐水制得NaClO,原理为:NaCl+H2O═NaClO+H2↑ | |
| D. | NaClO溶液在空气中发生离子反应为:2ClO-+CO2+H2O═2HClO+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com