
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )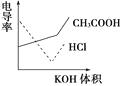
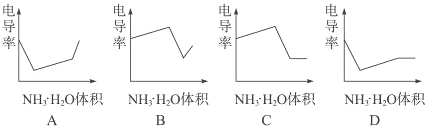
A.A
B.B
C.C
D.D
【答案】D
【解析】由KOH溶液滴定HCl和CH3COOH溶液的电导率变化关系图可以看出规律:①HCl被中和过程中电导率迅速下降,②CH3COOH被中和时电导率缓慢上升,③由拐点后迅速升高可推知强酸或强碱的量多少对电导率影响很大而弱酸和弱碱对电导率影响很小。根据以上三点分析NH3·H2O滴定HCl和CH3COOH混合溶液的过程为先中和HCl使电导率迅速降低,再中和CH3COOH,使电导率缓慢上升,后过量的NH3·H2O对电导率的影响很小(特别是在大量NH4+存在抑制NH3·H2O电离的条件下),故应选D。
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法中正确的是
A. 常温下,23gNO2和N2O4的混合气体中含有NA个氧原子
B. 1mol 氯气与足量的氢氧化钠溶液反应电子转移总数为2NA
C. 1L0.5mol·L-1FeCl3 溶液完全转化可制得0.5NA 个Fe(OH)3 胶粒
D. 标况下11.2LH2O 与4.0gCH4所含氢原子个数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由等体积、等pH的Ba(OH)2、NaOH、NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3 , 则三者的大小关系正确的是( )
A.V3>V2>V1
B.V3=V2=V1
C.V3>V2=V1
D.V1=V2>V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质和非电解质的说法正确的是:( )
A. BaSO4难溶于水,是弱电解质
B. NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质。
C. 石墨能够导电,但不是电解质也不是非电解质
D. 熔融Na2O能导电而固体Na2O不能导电,所以熔融Na2O是电解质,固体Na2O是非电解质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的结构和性质的叙述中正确的是
A. ![]() 、
、![]() 、
、![]() 互为同系物
互为同系物
B. 丙烯和苯分子所有原子均在同一平面内
C. 乙烯和聚乙烯均可使酸性高锰酸钾溶液褪色
D. 有机物M分子式为C6H12O2且能与NaHCO3溶液反应产生CO2,其同分异构体有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是( )
A.乙醇与浓硫酸加热到140℃
B.苯与浓硝酸、浓硫酸混合共热制取硝基苯
C.乙醇与氧气反应生成醛
D.乙醇与浓硫酸、溴化钠共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是

A. Cu和浓硝酸 B. CaO和浓氮水 C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
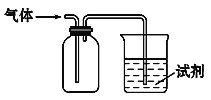
选项 | 试剂 | 现象 | 结论 |
A | KMnO4酸性溶液 | 溶液褪色 | SO2有氧化性 |
B | H2S溶液 | 淡黄色沉淀 | SO2有氧化性 |
C | NaOH溶液 | 无明显现象 | SO2与NaOH溶液不反应 |
D | 紫色石蕊试液 | 溶液变红色后不褪色 | SO2有酸性、没有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com