
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:![]()
已知转化过程中的反应为2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
Cr2O72﹣(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要917.4 g
C. 常温下转化反应的平衡常数K=l×1014.则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
【答案】B
【解析】试题分析: CrO42﹣为黄色的,Cr2O72﹣为橙色的,溶液颜色保持不变,说明各物质的浓度不再改变,则反应达到达平衡状态,A对,不选;液中铬元素的含量为28.6 g/L,在1L废水中铬元素的物质的量为n(Cr)="28.6g/L×1l÷" 52g/mol ="0.55mol" , Cr的化合价为 +6价,反应后变为+3价,Fe2+反应后变为Fe3+,根据氧化还原反应中电子得失数目相等可得:n(Fe2+)=3×0.55mol=1.65mol,则m(FeSO4·7H2O) = 1.65mol×278g/mol=458.7g,B错,选B;反应 2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O的平衡常数为K= c(Cr2O72-)/ c2(H+)·c(CrO42-),c(CrO42-)=[(28.6÷52)÷11]mol/L=0.05mol/L,c(Cr2O72-)=(11÷2)×c(CrO42-)=0.25mol/L,则可得c(H+)=10-6mol/L,故pH=6,C对,不选;根据溶度积的表达式有: c(Cr3+)·c3(OH-)=1×10﹣32,c3(OH-)=10﹣32÷10﹣5=10﹣27,得c(OH-)=1×10﹣9,则c(H+)=10﹣5,所以 pH=5,D对,不选。
Cr2O72﹣(aq)+H2O的平衡常数为K= c(Cr2O72-)/ c2(H+)·c(CrO42-),c(CrO42-)=[(28.6÷52)÷11]mol/L=0.05mol/L,c(Cr2O72-)=(11÷2)×c(CrO42-)=0.25mol/L,则可得c(H+)=10-6mol/L,故pH=6,C对,不选;根据溶度积的表达式有: c(Cr3+)·c3(OH-)=1×10﹣32,c3(OH-)=10﹣32÷10﹣5=10﹣27,得c(OH-)=1×10﹣9,则c(H+)=10﹣5,所以 pH=5,D对,不选。


科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
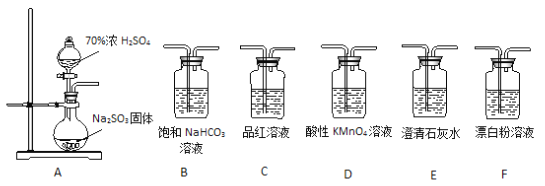
(1)装置A中反应的化学方程式为________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→_________→_________→C→F。
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。
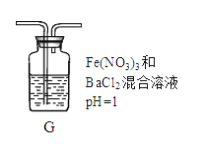
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:__________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是________________________。
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是______________,样品中Na2SO3质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 X(g)+Y(g)![]() 2Z(g) △H<0,在一定条件下,反应情况如图所示.若使曲线a变为曲线b可采取的措施是
2Z(g) △H<0,在一定条件下,反应情况如图所示.若使曲线a变为曲线b可采取的措施是

A.加入催化剂B.增大压强
C.降低温度D.保持容器体积不变,冲入He气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5 表示。有关说法正确的是

A. 该装置为原电池,b为原电池的负极
B. 中间室Na+移向右室,Cl-移向左室,a极区溶液的pH减小
C. 当左室有4.48L(标准状况下)CO2生成时,右室产生的N2为0.8mol
D. b电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下2gSiH4自燃放出热量89.2kJ.SiH4自燃的热变化方程式为_____。
(2)写出用惰性电极电解饱和食盐水的总电极反应式:_____。
(3)写出用惰性电极电解硫酸铜溶液的总化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.隔绝空气高温加热生物质,通过热化学转换可产生可燃性气体
B.光![]() 电转换的途径必定是发生了化学反应
电转换的途径必定是发生了化学反应
C.开发太阳能、氢能、核能、天然气等新能源可以减少霾的产生
D.植物秸秆发酵制沼气是在有氧条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向10mL.0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液。滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
(已知1g5=0.7)

A. x、y两点c(Ca2+)之比为2000:3 B. Ksp(CaCO3)=5×10-9
C. w点对应的分散系很稳定 D. x、y、z三点中,水的电离程度最大的为x点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液
②向红砖粉末中加入盐酸,充分振荡反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液呈红色,但不一定说明红砖中含有氧化铁
③制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
④磁性氧化铁溶于稀硝酸的离子方程式为3Fe2++4H++NO![]() =3Fe3++NO↑+3H2O
=3Fe3++NO↑+3H2O
⑤氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+3H+=Fe3++3H2O
⑥Fe(OH)3不能通过Fe2O3与水反应得到,但能通过化合反应制取Fe(OH)3
⑦赤铁矿的主要成分是Fe2O3,Fe2O3为红棕色粉末
A.①③⑤B.⑥⑦C.②④⑤D.④⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com