
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
(1)0.20/t1 (2)0.40 (3)增大 增大 (4)放热
解析试题分析:(1)在化学反应中速率比等于反应方程式各物质的化学计量数之比。反应在t1min内的平均速率为v(H2)=V(CO)="(" 1.2-0.8)mol÷2L÷t1min=0.20/t1mol/( L·min).(2)CO(g)+H2O(g) CO2+H2.在t1时n(CO)=0.80mol.变化了0.4mol.则n(H2O)=0.2mol.n(CO2)=n(H2) =0.4mol.由于t2<t1.说明在t1时反应已经达到平衡。因为反应前后物质的量保持不变,保持其他条件不变,平衡常数不会改变,起始时向容器中充入0.60molCO和1.20 molH2O,与起始时向容器中充入0.60molH2O和1.20 molCO效果是一致的,到达平衡时,n(CO2)=0.40 mol。(3)在其它条件不变的情况下,增大某反应物的浓度,能使其它反应物的转化率提高,而它本身的转化率反而降低。保持其他条件不变,向平衡体系中再通入0.20mol H2O,即增大了反应物的浓度化学平衡向正反应方向移动。与原平衡相比,达到新平衡时CO转化率增大,对H2O来说。增大水蒸汽的浓度,平衡正向移动使水蒸气的浓度减小,但平衡移动消耗量远远小于加入量,所以水的的体积分数增大。(4)温度升至800℃,该反应平衡常数为0.64,减小。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应是吸热反应,所以正反应是放热反应。
CO2+H2.在t1时n(CO)=0.80mol.变化了0.4mol.则n(H2O)=0.2mol.n(CO2)=n(H2) =0.4mol.由于t2<t1.说明在t1时反应已经达到平衡。因为反应前后物质的量保持不变,保持其他条件不变,平衡常数不会改变,起始时向容器中充入0.60molCO和1.20 molH2O,与起始时向容器中充入0.60molH2O和1.20 molCO效果是一致的,到达平衡时,n(CO2)=0.40 mol。(3)在其它条件不变的情况下,增大某反应物的浓度,能使其它反应物的转化率提高,而它本身的转化率反而降低。保持其他条件不变,向平衡体系中再通入0.20mol H2O,即增大了反应物的浓度化学平衡向正反应方向移动。与原平衡相比,达到新平衡时CO转化率增大,对H2O来说。增大水蒸汽的浓度,平衡正向移动使水蒸气的浓度减小,但平衡移动消耗量远远小于加入量,所以水的的体积分数增大。(4)温度升至800℃,该反应平衡常数为0.64,减小。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应是吸热反应,所以正反应是放热反应。
考点:考查外界条件对化学平衡、平衡混合物中各物质的浓度等影响的知识。


科目:高中化学 来源: 题型:填空题
25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。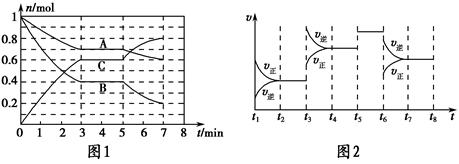
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。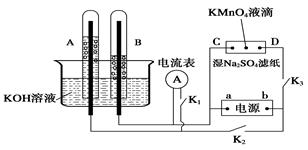
回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)  CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.课本中通过向草酸(H2C2O4)溶液中滴加用硫酸酸化高锰酸钾中研究浓度对化学反应速率的影响,请你写出该反应的化学方程式 ,该反应不需使用指示剂的原因是 ;
Ⅱ.某同学根据课本外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度(mol·L-1) | 体积(mL) | 浓度(mol·L-1) | 体积 (mL) | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
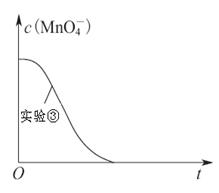
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.设反应①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
在不同温度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知反应A(g)+B(g) C(g)+D(g)△H<0回答下列问题:
C(g)+D(g)△H<0回答下列问题:
(1)该反应是________反应(填“吸热”或“放热”)
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”或“不变”)。原因是________________________________________。
(3)反应体系中加入催化剂,对反应热是否有影响?________;原因是_________________________________________________。
(4)反应体系中加入催化剂,反应速率________(填“增大”“减小”或“不变”);反应的活化能________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)  CO2(g)十H2 (g) △H<0 , CO和H2O浓度变化如下图,
CO2(g)十H2 (g) △H<0 , CO和H2O浓度变化如下图,
(1) 3min—4min之间反应处于____状态(填平衡、不平衡);
(2)要使反应在8min后,平衡向逆方向移动,可采取的措施是__ ___,要使反应在8min后,反应速率降低,平衡向正方向移动,可采取的措施是________。(填a,b,c,d)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)求出850℃ 时,该反应的平衡常数和CO的平衡转化率(写出详细计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH是最重要的研究方向之一。在2L的密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
①通过分析上图,可以得出对反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的说法正确的是(填
CH3OH(g)+H2O(g)的说法正确的是(填
序号) 。
| A.该反应为放热反应 |
| B.T1时的反应速率大于T2时的反应速率 |
| C.该反应在T1时的平衡常数比T2时的大 |
| D.处于A点的反应体系从T1变到T2,达平衡时n(H2)/n(CH3OH)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com