
【题目】下列各组微粒的立体构型相同的是( )
A.CO2与SO2
B.CH4与CCl4
C.NH3与BF3
D.H3O+与SO3
【答案】B
【解析】解:A.CO2分子是直线型分子,SO2中价层电子对个数都是3且都含有一对孤电子对,所以分子空间构型都是V形,故A错误;B.CH4与CCl4分子中C原子价层电子对个数均为4+ ![]() ×(4﹣4×1)=4,且不含孤电子对,所以CH4与CCl4分子均为正四面体结构,故B正确;
×(4﹣4×1)=4,且不含孤电子对,所以CH4与CCl4分子均为正四面体结构,故B正确;
C.NH3中价层电子对个数=3+ ![]() ×(5﹣3)=4且含有一个孤电子对,所以为三角锥形,BF3中B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以分子构型为平面正三角形,故C错误;
×(5﹣3)=4且含有一个孤电子对,所以为三角锥形,BF3中B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以分子构型为平面正三角形,故C错误;
D.H3O+中价层电子对个数都是3且含有一对孤电子对,所以为三角锥形结构,SO3中电子对数= ![]() ,S原子采取sp3杂化,分子空间构型为平面三角形,故D错误.
,S原子采取sp3杂化,分子空间构型为平面三角形,故D错误.
故选:B.


科目:高中化学 来源: 题型:
【题目】室温下,向10mL0.1molL﹣1醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.再加CH3COONa固体促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中 ![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2gCu与足量的浓硫酸在加热条件下充分反应。
(1)请写出反应的方程式_________________;
(2)若把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的BaCl2溶液,得到沉淀2.33g,则稀释后所得溶液中SO42-的物质的量浓度为_______________。
(3)若把反应后的溶液稀释至500mL,加入铁粉。最多能溶解__________g铁粉
(4)把产生的气体缓缓通入100mLamol/L的NaOH溶液中,若反应物均无剩余,则a的取值范围是___________________。
(5)若浓疏酸中含溶质bmol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的n(H2SO4)_______0.5bmol(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分 CuFeS2)制取 FeSO4·7H2O 和Cu的主要流程如下:

(1)检验酸浸过程中 Fe2+是否被氧化,应选择________(填字母编号)。
A.KMnO4 溶液 B.K3[Fe(CN)6]溶液 C.KSCN 溶液
(2)酸浸过程中主要反应的化学方程式为__________。
(3)某同学向盛有 H2O2 溶液的试管中加入几滴酸化的 FeSO4 溶液,溶液变成棕黄色,发生反应的离子方程式为___________。一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成;产生气泡的原因是_________,生成沉淀的原因是___________(用平衡移动原理解释)。
(4)已知 25℃时, Ksp[Fe(OH)3]=4.0×10-38, 此温度下,若实验室中配制 2.5mol/L 100 mLFe2(SO4)3 溶液,为使配制过程中不出现浑浊,则至少需要加10mol/L的硫酸______mL(忽略加入硫酸的体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的序号填在相应的横线上。
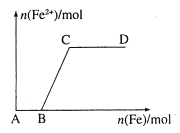
①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+
(1)AB段铁元素以________形式存在。
(2)BC段铁元素以________形式存在。
(3)CD段铁元素以________形式存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
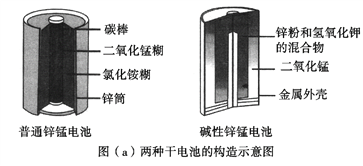
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2==Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是__________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点有_____________________。(任写一条)
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
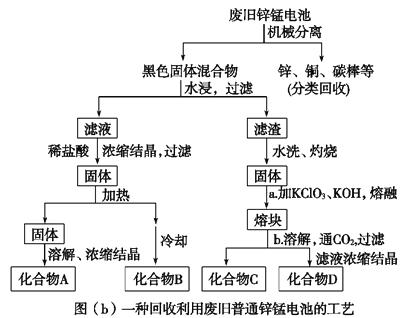
图(b)中产物的化学式分别为A_________________,B______________________。
(3)①操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液D和一种黑褐色固体C,该反应的离子方程式为_________________________。
②采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2 molSO2和1molO2充入 10 L恒容密闭容器中,发生反应:2SO2(g) +O2(g)![]() 2SO3(g) △H=-196 kJ·mol-1。5 min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
2SO3(g) △H=-196 kJ·mol-1。5 min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A. 0~5min内,用O2表示的平均反应速率v(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 molSO2和2 molO2,平衡时放出的热量小于333.2 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com