
下列解释事实的化学方程式或离子方程式正确的是
A.以MnO2为原料制得的MnCl2溶液中常含有Cu2+等金属离子,通常添加难溶电解质MnS使这些离子形成硫化物沉淀而除去:Cu2+ + S2-=CuS↓
B.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH- = SiO32- + H2O
C.金属钠在空气中放置表面会很快失去金属光泽:2Na + O2 = Na2O2
D.向硫酸亚铁铵[(NH4)2Fe(SO4) 2·6H2O]的稀溶液中加入足量Ba(OH)2稀溶液:NH4+ + Fe2+ + SO42-+ Ba2+ +3OH- = BaSO4↓+ Fe(OH)2↓+ NH3·H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏氯乙烯(PVDC)等种类。PVC被广泛地用于食品、蔬菜外包装,它对人体有潜在危害。下列有关叙述不正确的是  ( )。
( )。
A.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
B.PVC单体可由PE的单体与氯化氢加成制得
C.鉴别PE和PVC,可把其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则是PVC;不变红, 则为PE
则为PE
D.等质量的聚乙烯和乙烯完全燃烧消耗的氧气一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=12.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-12 mol·L-1
B.所加的烧碱溶液pH=12.0
C.所得溶液中由水电离产生的c(OH-)=1.0×10-12 mol·L-1
D.所得溶液中的c(Mg2+)=5.6×10-8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于常温下,pH=3的醋酸溶液(I)和 pH=11的氢氧化钠溶液(Ⅱ)的说法正确的是( )
A.I和Ⅱ的物质的量浓度均为0.001mol·L-1
B.将I稀释10倍,溶液中 c(CH3COOH)、 c(OHˉ)均减小
C.I和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量
D.I和Ⅱ等体积混合后,溶液中离子浓度大小为c(CH3COO-)c(Na+)> c(H+)> c(OH--)
查看答案和解析>>
科目:高中化学 来源: 题型:
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是
A.N5+ 离子中含有36个电子 B.H2与H3属于同素异形体
C.C60的摩尔质量为720 D.O2与O4属于同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
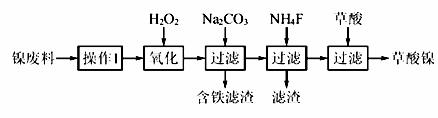
(1)操作1为 。
(2)生产过程中多次进行过滤,实验室进行过滤操作中需用到玻璃棒,下列实验操作中哪些操作中玻璃棒的作用完全相同的是 (填选项字母)。
①配制0.1mol/L的H2SO4溶液
②测定Na2CO3溶液的pH
③用KI淀粉试纸检验溶液中的氧化性离子
④加热食盐溶液制备NaCl晶体
⑤配制20%的KNO3溶液
A.①⑤ B.②③ C.④⑤ D.①④
(3)加入H2O2发生的主要反应的离子方程式为 ;加入Na2CO3溶液调pH至4.0~4.5,其目的为 ; 加入NH4F后除掉的杂质是 。
加入NH4F后除掉的杂质是 。
(4)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为 。
(5)工业上还可用电解法制取Ni2O3。用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后采用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(6)电解法制取Ni2O3的实际过程中,有时获得一种结晶水合物,已知含1molNi的该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,获得Ni2O3固体和0.2mol水,则该结晶水合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
“砳砳”(音:lèlè乐乐)是2014年第二届夏季青年奥林匹克运动会吉祥物(如图),制作它的外部材料为纯羊毛绒,内充无毒的合成纤维。下列说法正确的是 ( )

A.制作“砳砳”的内充物是引起白色污染的主要物质
B.纯羊毛和合成纤维可用燃烧法区别
C.制作“砳砳”的外部材料属于有机合成材料
D.合成纤维的吸水性和透气性比纯羊毛好
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-====HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol·L-1HX溶液的电离常数大于0.1 mol·L-1HX
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,将V1mLc1mol·L-1的氨水滴加到V2mLc2mol·L-1的盐酸中,下述结论中正确的是( )
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则混合液中c(N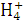 )=c(Cl-)
)=c(Cl-)
C.若混合溶液的pH=7,则混合液中c(N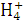 )>c(Cl-)
)>c(Cl-)
D.若V1=V2,且混合溶液的pH<7,则一定有c1<c2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com