

·ÖĪö £Ø1£©ÓÉ¢ŁCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©”÷H1=-100kJ•mol-1
¢ŚCO2£Øg£©+3H2£Øg£©?CH3OH£Øg£©+H2O£Øg£©”÷H2=-58kJ•mol-1
½įŗĻøĒĖ¹¶ØĀÉæÉÖŖ£¬¢Ś-¢ŁµĆµ½CO2£Øg£©+H2£Øg£©?CO£Øg£©+H2O£Øg£©£»
£Ø2£©¢Ū=¢Ś-¢Ł£¬ŌņKĪŖÖøŹż¹ŲĻµ£¬ÉżøßĪĀ¶ČĘ½ŗāĻņĪüČȵķ½ĻņŅĘ¶Æ£»
£Ø3£©ÓÉĶ¼æÉÖŖ$\frac{n£Ø{H}_{2}£©}{n£ØCO+C{O}_{2}£©}$=2.60Ź±”¢ĻąĶ¬ĪĀ¶ČĻĀ£¬Ōö“óŃ¹Ē棬ӊĄūÓŚĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬COµÄ×Ŗ»ÆĀŹŌö“ó£»
£Ø4£©¼×“¼ŌŚ“߻ƼĮ×÷ÓĆĻĀĢį¹©ÖŹ×Ó£ØH+£©ŗĶµē×Ó£¬Ōņøŗ¼«ÉĻ¼×“¼Ź§Č„µē×ÓÉś³É¶žŃõ»ÆĢ¼£®
½ā“š ½ā£ŗ£Ø1£©ÓÉ¢ŁCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©”÷H1=-100kJ•mol-1
¢ŚCO2£Øg£©+3H2£Øg£©?CH3OH£Øg£©+H2O£Øg£©”÷H2=-58kJ•mol-1
½įŗĻøĒĖ¹¶ØĀÉæÉÖŖ£¬¢Ś-¢ŁµĆµ½CO2£Øg£©+H2£Øg£©?CO£Øg£©+H2O£Øg£©£¬Ōņ”÷H3=£Ø-58kJ•mol-1£©-£Ø-100kJ•mol-1£©=+42kJ•mol-1£¬
¹Ź“š°øĪŖ£ŗ+42£»
£Ø2£©¢Ū=¢Ś-¢Ł£¬æÉÖŖ¢Ł=¢Ś-¢Ū£¬ŌņK1=$\frac{{K}_{2}}{{K}_{3}}$£¬¢ŪĪŖĪüČČ·“Ó¦£¬Ėę×ÅĪĀ¶ČµÄÉżøߣ¬Ę½ŗāÕżĻņŅĘ¶Æ£¬K3Ōö“ó£¬
¹Ź“š°øĪŖ£ŗ$\frac{{K}_{2}}{{K}_{3}}$£»Ōö“ó£»
£Ø3£©ĻąĶ¬ĪĀ¶ČĻĀ£¬·“Ó¦¢ŪĒ°ŗóĘųĢå·Ö×ÓŹż²»±ä£¬Ń¹Ēæøı䲻ӰĻģĘäĘ½ŗāŅĘ¶Æ£¬·“Ó¦¢Ł¢ŚµÄÕż·“Ó¦¾łĪŖĘųĢå·Ö×ÓŹż¼õŠ”µÄ·“Ó¦£¬Ōö“óŃ¹Ē棬ӊĄūÓŚĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬COµÄ×Ŗ»ÆĀŹŌö“󣬹ŹŌö“óŃ¹ĒæÓŠĄūÓŚCOµÄ×Ŗ»ÆĀŹÉżøߣ¬½įŗĻĶ¼æÉÖŖ£¬×īÉĻ·½Ń¹Ēæ¶ŌÓ¦×Ŗ»ÆĀŹ×ī“ó£¬ŌņŃ¹ĒæĪŖp1£¼p2£¼p3£¬
¹Ź“š°øĪŖ£ŗp1£¼p2£¼p3£»
£Ø4£©¼×“¼ŌŚ“߻ƼĮ×÷ÓĆĻĀĢį¹©ÖŹ×Ó£ØH+£©ŗĶµē×Ó£¬Ōņøŗ¼«ÉĻ¼×“¼Ź§Č„µē×ÓÉś³É¶žŃõ»ÆĢ¼£¬øŗ¼«·“Ó¦ĪŖCH3OH+H2O-6e-=CO2+6H+£¬
¹Ź“š°øĪŖ£ŗCH3OH+H2O-6e-=CO2+6H+£®
µćĘĄ ±¾Ģā漲鷓ӦČČÓėģŹ±ä”¢Ę½ŗā³£Źż”¢Ę½ŗāŅĘ¶Æ¼°Ōµē³Ų£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕøĒĖ¹¶ØĀÉÓ¦ÓĆ”¢·“Ó¦µÄ¹ŲĻµ”¢Ę½ŗāŅʶÆŌĄķ¼°µē¼«·“Ó¦ŹéŠ“ĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬×ŪŗĻŠŌ½ĻĒ棬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
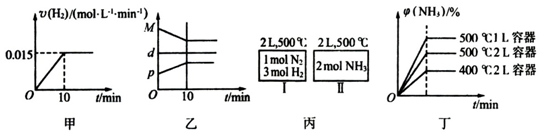
| A£® | Čō“ļµ½Ę½ŗāŹ±£¬²āµĆĢåĻµ·Å³ö9.24kJČČĮ棬ŌņH2·“Ó¦ĖŁĀŹ±ä»ÆĒśĻßČēĶ¼¼×ĖłŹ¾ | |
| B£® | ·“Ó¦¹ż³ĢÖŠ£¬»ģŗĻĘųĢåĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæĪŖM£¬»ģŗĻĘųĢåĆܶČĪŖd£¬»ģŗĻĘųĢåŃ¹ĒæĪŖp£¬ČżÕß¹ŲĻµČēĶ¼ŅŅ | |
| C£® | ČēĶ¼±ūĖłŹ¾£¬ČŻĘ÷IŗĶII“ļµ½Ę½ŗāŹ±£¬NH3µÄĢå»ż·ÖŹżĪŖ¦Õ£¬ŌņČŻĘ÷I·Å³öČČĮæÓėČŻĘ÷IIĪüŹÕČČĮæÖ®ŗĶĪŖ92.4kJ | |
| D£® | ČōĘšŹ¼¼ÓČėĪļĮĻĪŖ1 mol N2£¬3 mol H2£¬ŌŚ²»Ķ¬Ģõ¼žĻĀ“ļµ½Ę½ŗāŹ±£¬NH3µÄĢå»ż·ÖŹż±ä»ÆČēĶ¼¶”ĖłŹ¾ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 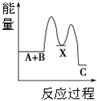 ·“Ó¦A+B”śC£Ø”÷H£¼0£©·ÖĮ½²½½ųŠŠ£ŗ¢ŁA+B”śX£Ø”÷H£¾0£©£¬¢ŚX”śC£Ø”÷H£¼0£©£¬Ķ¼±ķŹ¾×Ü·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»Æ | |
| B£® | 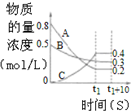 Ķ¼±ķŹ¾·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ3A+BØT2C | |
| C£® | 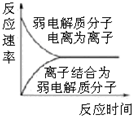 Ķ¼±ķŹ¾Čõµē½āÖŹŌŚĖ®ÖŠ½ØĮ¢µēĄėĘ½ŗāµÄ¹ż³Ģ | |
| D£® | 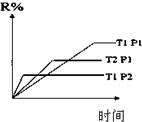 Ķ¼±ķŹ¾·“Ó¦M£Øg£©+N£Øg£©?R£Øg£©+2L£Ø£æ£©ŹĒ·ÅČČ·“Ó¦ĒŅLŹĒĘųĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ¼ÓĖ®Ź±£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ | |
| B£® | ĶØČėÉŁĮæHCl£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ | |
| C£® | ¼ÓČėÉŁĮæ0.1mol/LNaOH£¬ČÜŅŗÖŠc£ØOH-£©¼õŠ” | |
| D£® | ¼ÓČėÉŁĮæNH4Cl¹ĢĢå£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
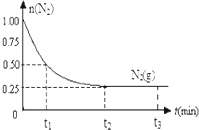 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1mol N2ŗĶ3mol H2£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©£¬²āµĆĘäÖŠN2£Øg£©ĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆČēĶ¼£®
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1mol N2ŗĶ3mol H2£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©£¬²āµĆĘäÖŠN2£Øg£©ĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆČēĶ¼£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
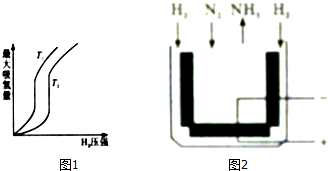
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÅØĮņĖįŗĶÅØĻõĖį¼ÓĖ®Ļ”ŹĶŗó¶¼ÄÜÓė½šŹōĶ·“Ó¦ | |
| B£® | ÅØĮņĖįŗĶÅØĻõĖį¶¼²»ÄÜÓĆĄ“Ö±½ÓøśŠæĮ£·“Ó¦ÖĘĒāĘų | |
| C£® | ÅØĮņĖįŗĶÅØĻõĖįŌŚ³£ĪĀĻĀ¶¼ÄÜÓĆ½šŹōĀĮÖĘČŻĘ÷Ź¢·Å | |
| D£® | ÅØĮņĖįŗĶÅØĻõĖį¶¼ÄÜÓėµ„ÖŹĢ¼·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com