
分析 i.(1)S的原子结构为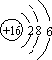 ,电子层数等于周期数,最外层电子数等于族序数;
,电子层数等于周期数,最外层电子数等于族序数;
(2)硒(34Se)与硫在元素周期表中位于同一主族,性质相似,非金属性S>Se;
(3)氯气具有强氧化性,SO32-中+4价的硫具有还原性,氯气与SO32-会发生氧化还原反应;溶液显碱性时能与溴水反应,不能确定溴水与SO32-会发生氧化还原反应;
ii.(1)元素电子层数等于其周期数;
(2)金属与水、酸反应越剧烈,金属性越强;同周期自左而右,核电荷数增大、原子半径减小,原子核对核外电子吸引增强,金属性减弱;
(3)①NaH与水发生氧化还原反应生成NaOH与H2,所含元素化合价升高的物质为还原剂;
②NaAlH4与水反应生成偏铝酸钠与氢气.
解答 解:i.(1)S的原子结构为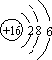 ,则S位于第三周期ⅥA族,
,则S位于第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)a.水中含氢键,沸点最高,则沸点:H2O>H2Se>H2S,故a错误;
b.非金属性S>Se,则H2Se比H2S稳定性弱,故b错误;
c.同主族,原子序数大的原子半径大,则Se的原子半径比S原子大,故c正确;
d.SeO2和SO2含有共价键,化学键类型相同,故d正确;
故答案为:c d;
(3)①吸收SO2后的碱性溶液还可用于Cl2的尾气处理,亚硫酸钠与氯气发生氧化还原反应生成硫酸钠和盐酸,则吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-,故答案为:SO42-、Cl-;
②滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色,
故答案为:NaOH溶液能跟溴单质反应,使溶液呈无色;
ii.(1)Na、Mg、Al原子核外均有3个电子层,均处于第三周期,故答案为:第三周期;
(2)金属与水、酸反应越剧烈,金属性越强,则金属性:Na>Mg>Al;同周期自左而右,核电荷数增大、原子半径减小,原子核对核外电子吸引增强,失去电子能力减弱,金属性减弱,
故答案为:Na>Mg>Al;原子半径逐渐减小,失电子能力逐渐减弱;
(3)①NaH与水发生氧化还原反应生成NaOH与H2,反应中水中氢元素化合价降低、NaH中氢元素化合价升高,故NaH是还原剂,
故答案为:NaH;
②NaAlH4与水反应生成偏铝酸钠与氢气,反应方程式为:NaAlH4+2H2O=NaAlO2+4H2↑,
故答案为:NaAlH4+2H2O=NaAlO2+4H2↑.
点评 本题考查较综合,涉及元素在周期表中的位置、氧化还原反应、化学键及同族元素的性质等,综合性较强,侧重分析与应用能力及化学反应原理的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在周期表中,族序数都等于该族元素的最外层电子数 | |
| B. | 同一主族的两种元素的原子序数之差可能是44 | |
| C. | 卤素单质随原子序数的增大,其熔沸点逐渐降低 | |
| D. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(B2)=1.2mol/(L•s) | B. | v(A2)=0.4 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(B2)=0.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
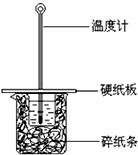 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )| A. | 采用0.55mol/L的NaOH溶液是保证盐酸完全被中和 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是保温隔热,防止热量损失 | |
| D. | 若烧杯上不盖硬纸板,测得的△H将偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4N03是离子化合物,KN03是共价化合物 | |
| B. | NH4N03是共价化合物,KN03是离子化合物 | |
| C. | NH4N03和KN03都是离子化合物 | |
| D. | NH4N03和KN03都是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com