
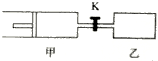
 如图,甲容器有一个移动活塞,能使弃器保持恒压.起始时向甲中充入2mol SO2、1mol O2,向乙中充入4mol SO2、2mol O2.甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:2SO2(g)+O2(g)?2SO3(g).达平衡时,甲的体积为0.8L.下列说法正确的是( )
如图,甲容器有一个移动活塞,能使弃器保持恒压.起始时向甲中充入2mol SO2、1mol O2,向乙中充入4mol SO2、2mol O2.甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:2SO2(g)+O2(g)?2SO3(g).达平衡时,甲的体积为0.8L.下列说法正确的是( )| A. | 乙容器中SO2的转化率小于60% | |
| B. | 平衡时SO3的体积分数:甲>乙 | |
| C. | 打开K后一段时间.再次达到平衡.甲的体积为1.4 L | |
| D. | 平衡后向甲中再充入2mol SO2、1mol O2.和3moLSO3,平衡向正反应方向移动 |
分析 根据图象知,A保持恒容,B保持恒压,
A、因为甲容器中是恒压过程,利用三段式,根据体积之比等物质的量之比,可以求得参加反应的X的物质的量,再求得SO2的转化率;
B、根据上述分析,乙容器相当于在甲容器的基础上增大压强,平衡会正向移动;
C、打开K达新平衡等效为甲中到达的平衡;
D、平衡后向甲中再充入2mol SO2、1mol O2.和3moLSO3,相当于原来的基础上增加三氧化硫的浓度.
解答 解:根据图象知,A保持恒容,B保持恒压,
A、因为甲容器中是恒压过程,利用三段式,根据体积之比等物质的量之比,可以求得参加反应的X的物质的量,再求得SO2的转化率;
设反应转化了的X的物质的量为xmol,则:
2SO2(g)+O2(g)?2SO3(g).
起始(mol) 2 1 0
反应(mol) 2x x 2x
平衡(mol) 2-2x 1-x 2x
平衡时容器内气体的物质的量为=(2-2x)+(1-x)+2x=(3-x)mol,根据气体体积比等于物质的量之比,
$\frac{(2+1)mol}{1L}=\frac{3-x}{0.8L}$
解得:x=0.6,所以物质SO2的转化率 $\frac{2x}{2}$×100%,故为60%,乙容器相当于在甲容器的基础上增大压强,平衡会正向移动,二氧化硫的转化率增大,故大于60%,故A错误;
B、根据上述分析,乙容器相当于在甲容器的基础上增大压强,平衡会正向移动,平衡时SO3的体积分数:甲<乙,故B错误;
C、打开K达新平衡等效为甲中到达的平衡,甲乙等效,若为打开K时,乙中的气体物质的量相当于甲的两倍,打开K时,气体的体积也该为甲的两倍,即1.6L,但乙只有1L,故甲应增加0.6L,故甲的体积为0.8+0.6=1.4L,故C正确;
D、平衡后向甲中再充入2mol SO2、1mol O2.和3moLSO3,相当于原来的基础上增加三氧化硫的浓度,平衡逆向移动,故D错误.
故选C.
点评 本题主要考查学生化学平衡的有关计算以及化学平衡移动的有关知识,注意打开K达新平衡等效为甲中到达的平衡是解题关键,难度大.


科目:高中化学 来源: 题型:选择题
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量的HCl气体,可将此混合气体通过盛有饱和食盐水的洗气瓶 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 自来水可以直接养金鱼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Br2(g)?2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变 | |
| B. | 2NO2(g)?N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变 | |
| C. | CaCO3(s)?CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变 | |
| D. | 3H2(g)+N2(g)?2NH3(g) 反应体系中H2与N2的物质的量之比保持3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将铁片放入浓硫酸中 | 无明显现象 | 铁片发生了钝化 |
| B | 将SO2通入Na2CO3溶液中,将产生的气体再通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明酸性: H2SO3>H2CO3>H2SiO3 |
| C | 向含有Fe3+的溶液中滴加KSCN溶液 | 溶液变红色 | 有Fe(SCN)3生成 |
| D | 向KOH溶液中滴加FeCl3溶液 | 有红褐色沉淀生成 | OH-+Fe3+=Fe(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
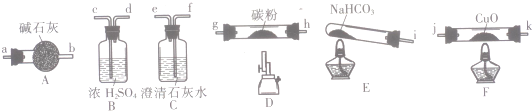
| 实验编号 | 操作 | 现象 |
| a | 加入足量稀硝酸、振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
| b | 加入足量稀硫酸、振荡 | 试管内有红色固体,溶液为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.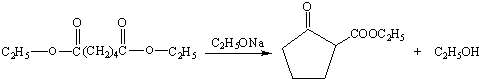 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
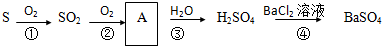
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子多 | |
| C. | 1 mol A从酸中置换出H2比1 mol B多 | |
| D. | 常温下,A能从酸中置换出氢气,而B不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应过程的热效应称为燃烧热 | |
| B. | 该过程是吸热反应 | |
| C. | 生成物的总能量等于反应物的总能量 | |
| D. | 化学能转变成热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com