
| A. | 向醋酸钠水溶液中通入少量CO2:2CH3COO-+CO2+H2O═2CH3COOH+CO32- | |
| B. | 向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 | |
| C. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO${\;}_{4}^{-}$+6H++5H2O2═2Mn2++5O2↑+8H2O |
分析 A.碳酸的酸性比醋酸的弱;
B.亚铁离子、溴离子均全部被氧化;
C.发生沉淀转化;
D.盐酸能被高锰酸钾氧化.
解答 解:A.向醋酸钠水溶液中通入少量CO2,不发生离子反应,故A错误;
B.向FeBr2溶液中通过量的Cl2的离子反应为2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2,故B错误;
C.向FeCl3溶液中加入Mg(OH)2的离子反应为3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+,故C正确;
D.盐酸、过氧化氢均能与高锰酸钾发生氧化还原反应,则用浓盐酸酸化的KMnO4溶液与H2O2反应,不能证明H2O2具有还原性,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应方程式书写的方法为解答的关键,侧重氧化还原反应、沉淀转化的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何物质都含有6.02×1023个分子 | |
| B. | 12g 12C中含有约6.02×1023个碳分子 | |
| C. | 1 mol水中含有2 mol氢元素和1 mol氧元素 | |
| D. | 1 mol Ne中含有约6.02×1024个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 证明乙烯有还原性 | 将乙烯气体通入酸性KMnO4溶液中 |
| B | 比较H2O和乙醇中羟基氢的活泼性 | 分别加入少量Na |
| C | 检验溴乙烷中的溴原子 | 加入NaOH溶液,加热,然后加入AgNO3溶液 |
| D | 鉴别1-丙醇和2-丙醇 | 核磁共振氢谱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
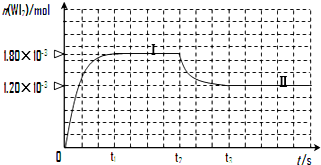 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com