
| A. | 16O2与18O2互为同分异构体 | |
| B. | 16O与18O核外电子排布方式相同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子 |
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子由1个u夸克和及1个d夸克组成,中子由1个u夸克和2个d夸克组成 | |
| B. | 质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 | |
| C. | 质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成 | |
| D. | 质子由2个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,2.3g Na完全与O2反应生成3.6g产物时得到的电子数为0.1NA | |
| B. | 1L 0.1mol醋酸溶液中所含分子数少于0.1NA | |
| C. | 水分子中1mol羟基含有的电子总数为9NA | |
| D. | 1 mol H2O2含有极性共价键键数为NA,含有非极性共价键为键数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{214}$Pu位于周期表中第六周期 | |
| B. | ${\;}_{53}^{131}$ I与${\;}_{53}^{125}$I性质完全相同 | |
| C. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I 互为同位素 | |
| D. | ${\;}_{53}^{131}$I的质子数为78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )
锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )| A. | 正极一侧为有机电解液 | B. | 放电过程中LiOH在正极生成 | ||
| C. | 放电时Li+从正极区移向负极区 | D. | 专用充电电极可以是铁、铜等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
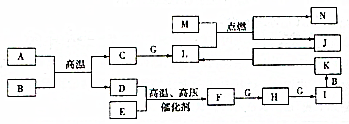 已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答:
已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
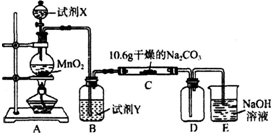
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立;结合步骤2中的②,则假设二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原 | |
| B. | CuI既是氧化产物又是还原产物 | |
| C. | 每生成1 mol CuI,有12 mol KI发生氧化反应 | |
| D. | 每转移1.1 mol电子,有0.2 mol $\stackrel{+5}{I}$被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com