
【题目】人们对苯及芳香烃的认识是一个不断深化的过程。
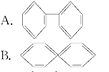
(1)已知分子式为C6H6的烃结构有多种,其中的两种为![]()
①下列反应中Ⅰ能________(填字母)而Ⅱ不能。
a.被酸性高锰酸钾溶液氧化 b.与溴水发生加成反应
c.与液溴发生取代反应 d.在空气中可以燃烧
②1 mol 物质与H2加成时, Ⅰ 需H2________mol,而 Ⅱ 需H2________mol。
③Ⅰ的一氯取代产物有_______种,Ⅱ的二氯取代产物有______种
![]()
(2)今发现C6H6还可能有另一种立体结构(如图所示),该结构的二氯代物有____________种。
(3)下列四种芳香烃中,属于苯的同系物的是______
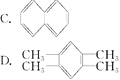
(4)现代化学认为苯分子中碳碳之间的键是____________________________。
【答案】ab 2 3 2 3 3 D 介于单键和双键之间的一种特殊的化学键
【解析】
(1)①由结构简式可知,Ⅰ分子中含有碳碳双键,Ⅱ分子中含有苯环,不含有碳碳双键;
②Ⅰ分子中含有2个碳碳双键,Ⅱ分子中含有1个苯环;
③Ⅰ分子结构对称,含有2类氢原子,Ⅱ的分子结构完全对称,分子中只含有1类氢原子,一氯取代产物分子中只含有3类氢原子;
(2)![]() 分子结构高度对称,分子中只含有1类氢原子,一氯代物有分子中只含有3类氢原子;
分子结构高度对称,分子中只含有1类氢原子,一氯代物有分子中只含有3类氢原子;
(3)分子中只含有1个苯环,侧链为烷烃基的芳香烃与苯互为苯的同系物;
(4)现代化学认为苯分子中碳碳之间的键是一种介于单键和双键之间的一种特殊的化学键。
(1)①由结构简式可知,Ⅰ分子中含有碳碳双键,Ⅱ分子中含有苯环,不含有碳碳双键,则Ⅰ能溴水发生加成反应,能被酸性高锰酸钾溶液氧化,而Ⅱ不能,ab正确,故答案为:ab;
②Ⅰ分子中含有2个碳碳双键,1 molⅠ能与2mol H2发生加成反应,Ⅱ分子中含有1个苯环,1 molⅡ能与3mol H2发生加成反应,故答案为:2;3;
③Ⅰ分子结构对称,含有2类氢原子,则一氯取代产物有2种;Ⅱ的分子结构完全对称,分子中只含有1类氢原子,一氯取代产物有1种,则其二氯取代产物有邻、间、对3种,故答案为:2;3;
(2)![]() 分子结构高度对称,分子中只含有1类氢原子,一氯代物有1种,其二氯代物有3种,具体如下图
分子结构高度对称,分子中只含有1类氢原子,一氯代物有1种,其二氯代物有3种,具体如下图 (1为三角形边、2为正方形边、3为体对角线),故答案为:3;
(1为三角形边、2为正方形边、3为体对角线),故答案为:3;
(3)分子中只含有1个苯环,侧链为烷烃基的芳香烃与苯互为苯的同系物,![]() 、
、![]() 和
和![]() 分子中含有2个苯环,不属于苯的同系物,
分子中含有2个苯环,不属于苯的同系物,![]() 分子中含有1个苯环,4个甲基,属于苯的同系物,则D正确,故答案为:D;
分子中含有1个苯环,4个甲基,属于苯的同系物,则D正确,故答案为:D;
(4)现代化学认为苯分子中碳碳之间的键是一种介于单键和双键之间的一种特殊的化学键,故答案为:介于单键和双键之间的一种特殊的化学键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同条件下,一定量的氢气在氧气中充分燃烧并放出热量。若生成液态水时放出的热量为Q1kJ,生成气态水时放出的热量为Q2kJ。则Q1 _______Q2(填“>”,“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的电子式是____________,其含有的化学键类型___________
(3)最高价氧化物是两性氧化物的素是________;写出它的氧化物与盐酸反应的离子方程式_________________________________________
(4)写出元素③的氢化物的电子式______________
(5)写出④的单质与水反应的离子方程式________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3固体 | Na2CO3固体 | / | 加热 |
B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
C | FeCl2溶液 | FeCl3溶液 | Cu | 过滤 |
D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.苯酚与乙醇的官能团都是羟基
B.炔烃的官能团是碳碳双键
C.官能团是反映一类化合物物理性质的原子或原子团
D.饱和一元羧酸的通式为CnH2n+2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com