
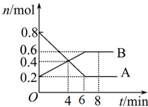
 某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.
某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=$\frac{△c}{△t}$计算反应速率;
(3)反应达平衡状态,各组分的浓度保持不变,由此分析解答;
解答 解:(1)由图象可以看出,反应中A的物质的量减小,B的物质的量增多,则A为反应物,B为生成物,
且△n(A):△n(B)=(0.8mol-0.2mol):(0.6mol-0.2mol)=3:2,则反应的化学方程式为:3A?2B;
故答案为:3A?2B;
(2)反应开始至4min时,A的物质的量变化为0.8mol-0.2mol=0.6mol,则v(A)=$\frac{\frac{△n}{V}}{t}$=$\frac{\frac{0.6mol}{2L}}{4min}$=0.075mol/(L•min);
故答案为:0.075mol/(L•min);
(3)反应达平衡状态,各组分的浓度保持不变,当6分钟时,各组分的浓度不变,故答案为:6;
点评 本题考查化学平衡图象分析题目,涉及反应方程式的确定、反应速率的计算、平衡状态等,题目难度中等,注意分析各物质的量的变化曲线,把握化学方程式的判断方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室用H2O2制取O2,加入MnO2后,反应速率明显加快 | |
| B. | 在金属钠与足量水的反应中,增加水的量能加快反应速率 | |
| C. | 对于可逆反应来说,可以通过改变条件改变反应进行的限度 | |
| D. | 当一个可逆反应达到平衡状态时,就是该反应在该条件下所能达到的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
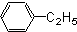 芳香烃,(7)
芳香烃,(7)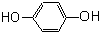 酚,(8)
酚,(8)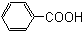 芳香酸.
芳香酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g | |
| D. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
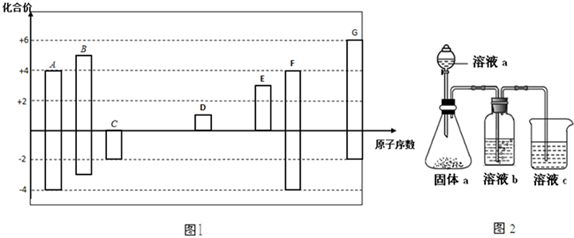
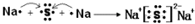 ,其所含化学键类型为离子键.
,其所含化学键类型为离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
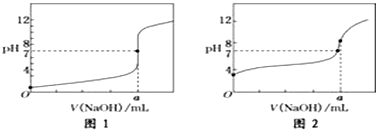
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com