
| A. | 第6周期,第ⅣA族 | B. | 第7周期,第ⅥA族 | C. | 第7周期,第ⅣA族 | D. | 第8周期,第ⅥA族 |
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题

| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 反应产生的热效应Q=E1-E2 | |
| C. | a与b相比,反应的平衡常数一定不同 | |
| D. | a与b相比,a的反应速率更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
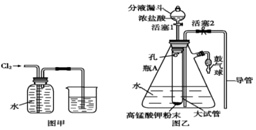 氯水是实验室常需临时配制的一种试剂,图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的、可用于向瓶中鼓入空气的仪器).
氯水是实验室常需临时配制的一种试剂,图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的、可用于向瓶中鼓入空气的仪器).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
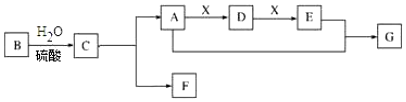
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 烧杯中的液体 | 现象(5分钟后) |
 | ①2mL1mol/LKl溶液+5滴淀粉 | 无明显变化 |
| ②2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L HCl | 溶液变蓝 | |
| ③2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L KCl | 无明显变化 | |
| ④2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
| 烧杯中的液体 | 现象(5小时后) |
| ⑤2mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
| ⑥2mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
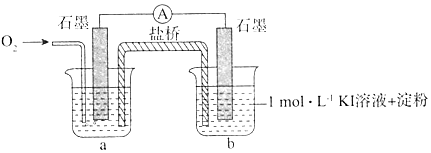
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素在人体内具有抗氧化、增强免疫力等功效 | |
| B. | 元素符号为 Sn | |
| C. | 在元素周期表中位于第四周期第ⅣA 族 | |
| D. | 属于金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com