
| A. | 硅是制造太阳能电池的常用材料 | |
| B. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 | |
| C. | Na2O2可用作呼吸面具中的供氧剂 | |
| D. | 二氧化硅是制造光导纤维的材料 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
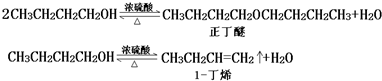
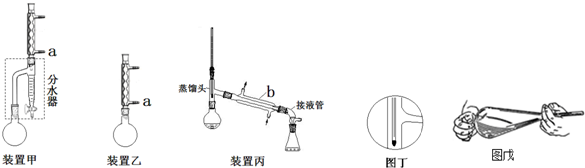
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热的方法区分纯碱和小苏打 | |
| B. | 用量筒量取5.0mL浓硫酸,并直接加水稀释 | |
| C. | 用分液漏斗分离苯和水的混合物 | |
| D. | 用托盘天平称量药品时,左盘放物品,右盘放砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的导电性介于金属和绝缘体之间,是良好的半导体 | |
| B. | 加热到一定温度时,硅能与氯气、氧气等非金属反应 | |
| C. | 利用二氧化硅与C反应能制得粗硅 | |
| D. | 二氧化硅性质较稳定,常温下不与任何物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
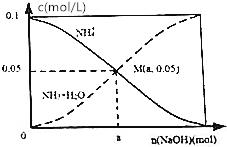 常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(0H-)-n(H+)=(a-0.05)mol | |
| C. | 随着Na0H的加入,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$不断减小 | |
| D. | 当n(NaOH)=0.1mol时,c(0H-)>c(C1-)>c(NH3•H20) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
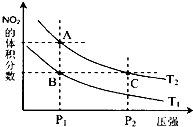 对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是bc.
对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是bc.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
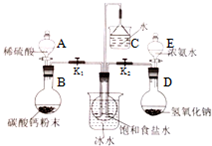 某课外活动小组模拟工业制备纯碱,方案如下:
某课外活动小组模拟工业制备纯碱,方案如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com