
| ||
| 22.4L×2mol |
| 2mol |
| ||
| ||
| ||
| 22.4L×1mol |
| 2mol |
| ||


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
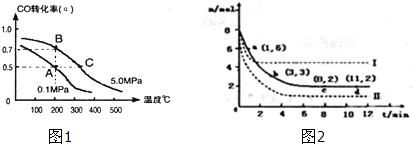
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、引起空气发生化学变化 |
| B、产生杀菌消毒作用 |
| C、诱发动植物的基因突变 |
| D、造成病毒感染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
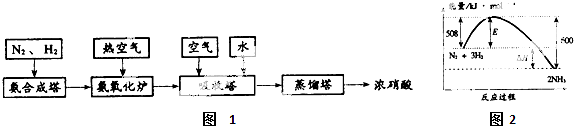

查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
| A、实验①中硝酸只和铁粉反应 |
| B、原混合物总质量为105.6g |
| C、硝酸浓度为4mol?L-1 |
| D、V=6720 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
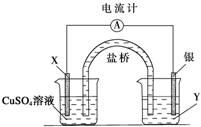 根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物中Cu和O的物质的量之比为2:1 |
| B、硝酸的物质的量浓度为2.6mol/L |
| C、产生的NO在标准状况下的体积为4.48L |
| D、Cu、CuO、Cu2O与硝酸反应后剩余HNO3为0.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com