
分析 (1)处于中间价态的微粒既有氧化性,也有还原性;
(2)硝酸参加反应生成Fe(NO3)3和NO,硝酸表现酸性和氧化性,反应中Fe元素化合价升高3价,N元素化合价由+5价降低到+2价;
(3)根据反应物为二氧化碳、亚铁离子,生成物为氧化铁、甲醛,判断二氧化碳在反应中的作用,然后写出反应的化学方程式.
解答 解:(1)+2价为Fe元素的中间价态,亚铁离子既有氧化性,也有还原性,故答案为:A;
(2)硝酸参加反应生成Fe(NO3)3和NO,硝酸表现酸性和氧化性,反应中Fe元素化合价升高3价,N元素化合价由+5价降低到+2价,1molFe参加反应时,被还原的HNO3为1mol,转移电子3mol,
故答案为:氧化;酸;1;3;
(3)CH2O中碳元素化合价为0,反应物二氧化碳中碳元素化合价为+4,说明二氧化碳化合价降低被还原,反应中做氧化剂;反应的离子方程式为:CO2+4Fe2++5H2O=CH2O+3Fe2O3+8H+,
故答案为:4Fe2+;3Fe2O3.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
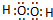 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
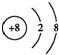 ;A、F两元素组成的化合物电子式为Na+[:H]-.
;A、F两元素组成的化合物电子式为Na+[:H]-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
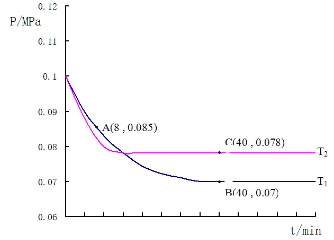 SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SrCO3的溶解度不变,KSP不变 | B. | SrCO3的溶解度不变,KSP增大 | ||
| C. | SrCO3的溶解度增大,KSP不变 | D. | SrCO3的溶解度减小,KSP增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO与NaOH溶液反应 H++OH-═H2O | |
| B. | CaCO3与稀盐酸反应 CO32-+2H+═CO2↑+H2O | |
| C. | Fe和稀H2SO4反应 2Fe+6H+═2Fe3++3H2↑ | |
| D. | 盐酸和Ba(OH)2溶液反应 H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3O2分子、COS分子中碳原子可能都采取sp杂化 | |
| B. | C3O2和CO2都是碳的氧化物,它们互为同分异构体 | |
| C. | COS是由极性键构成的非极性分子,分子中所有原子都满足8电子稳定结构 | |
| D. | COS在氧气中完全燃烧,生成物是CO2和SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com