
【题目】如图是元素周期表中短周期的一部分,若A元素原子的最外层电子数比次外层电子数少3,则下列说法正确的是( )
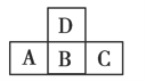
A.四种元素都是非金属元素
B.B与D之间能形成三种常见的化合物
C.A与C的原子序数之和跟B与D的原子序数之和相等
D.四种元素形成的单质在常温下都是气体
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】柠檬烯在食品中作为香料添加剂被广泛使用,其结构简式为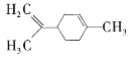 。下列有关柠檬烯的分析正确的是( )
。下列有关柠檬烯的分析正确的是( )
A.1mol柠檬烯完全燃烧消耗14molO2
B.分子中所有碳原子可能在同一平面上
C.和丁基苯(![]() )互为同分异构体
)互为同分异构体
D.一定条件下,可以发生加成反应、取代反应、氧化反应、酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2=+23.4kJ/mol
2CH3OH(g) △H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_______。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子断裂2NA个H-O键,同时氢分子断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正_______v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=_______%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=_______;KA、KB、KC三者之间的大小关系为________。

(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%。
×100%。
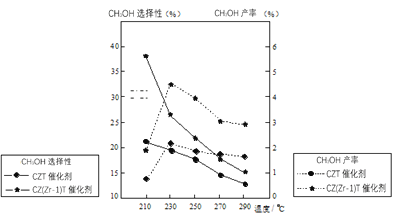
①温度高于230℃,CH3OH产率随温度升高而下降的原因是______。
②在上述条件下合成甲醇的工业条件是_______。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
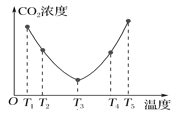
(6)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2 效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图,则ΔH______0(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al及其化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。
A [Ne]3s1 B [Ne]3s2 C [Ne]3s23p1 D [Ne] 3s13p2
(2)熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为_____(标出配位键);其中Al的配位数为_________。二聚体A12C16中Al原子的轨道杂化类型是________。
(3) 实际上,偏铝酸钠在水溶液中都是以Na[Al(OH)4]和形式存在,1mol Na[Al(OH)4]中含有σ键的数目为_________。
(4)Ga(镓)和铝是同一主族元素,Ga原子的电子排布式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是________(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
Ⅱ.常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示:
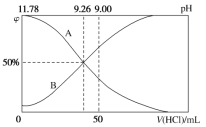
(3)根据图象回答下列问题。
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B”)。
②NH3·H2O的电离常数为______________。
③当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=______ mol·L-1(用数字计算式表示)。
Ⅲ.已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(4)称取2.000 g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有________。
(5)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为____________。终点时消耗标准溶液25mL,硝酸银样品纯度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,同时发生反应A(g)![]() B(g)和A(g)
B(g)和A(g)![]() C(g)。已知A(g)反应生成B(g)或C(g)的能量如图所示,下列说法正确的是
C(g)。已知A(g)反应生成B(g)或C(g)的能量如图所示,下列说法正确的是
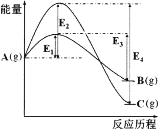
A.B(g)比C(g)稳定
B.在该温度下,反应刚开始时,产物以B为主;反应足够长时间,产物以C为主
C.反应A(g![]() )B(g)的活化能为(E3—E1)
)B(g)的活化能为(E3—E1)
D.反应A(g)![]() C(g)的ΔH<0且ΔS=0
C(g)的ΔH<0且ΔS=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中含有H+、![]() 、Na+、Mg2+、Fe2+、
、Na+、Mg2+、Fe2+、![]() 、Cl、Br、
、Cl、Br、![]() 、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
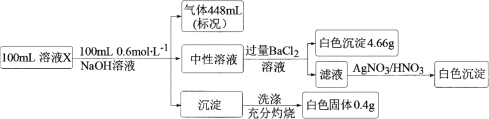
下列说法正确的是
A.溶液X中一定没有![]() 、SiO32-,可能有Na+、Fe2+
、SiO32-,可能有Na+、Fe2+
B.溶液X中加NaOH后,所得沉淀的成分可能有两种
C.溶液X中c(Cl)≤0.2 mol·L1
D.溶液X可能是由NH4HSO4、MgCl2按物质的量之比2∶1混合再溶于水配制而成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com