
 ,
, .
.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| 品名 | ××× |
| 配料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
| 保质期 | 240天 |
| 生产日期 | 标于包装袋袋封口上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省唐山一中高二上学期期中考试化学(文)试卷 题型:填空题
(4分)维生素和微量元素是生命基础的重要物质。如中学生每天需要补充维生素C约60 mg,微量元素碘约150 μg。 (1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变 色。
(1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变 色。 某同学欲探究维生素C的还原性,可选择的试剂是 (填序号)。
某同学欲探究维生素C的还原性,可选择的试剂是 (填序号)。 ①氨水、淀粉
①氨水、淀粉  ② KI溶液 ③酸性KMnO4溶液
② KI溶液 ③酸性KMnO4溶液 (2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为 (填序号)。
(2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为 (填序号)。 ① I2
① I2  ② KI ③ KIO3
② KI ③ KIO3 已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是 。
已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省五校协作体高一上学期期中考试化学试卷(解析版) 题型:填空题
(11分)
(1)维生素C 又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C 具有 性。(填氧化性或还原性)
(2)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S + 2KNO3 +3C =K2S+N2↑+3CO2↑.该反应的氧化剂是 ,当16g 硫参加反应时,转移的电子总数为 。
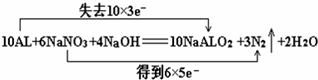
(3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。上述反应中,若有10个铝原子参与反应,则转移的电子数为 个,用“双线桥法”标明反应中电子转移的方向和数目。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com