
| 酸 | c(一元酸) /mol·L–1 | c(NaOH) /mol·L–1 | 混合溶液的pH |
| HX | 0.1 | 0.1 | pH = x |
| HY | 0.1 | 0.1 | pH = 7 |
| HZ | 0.1 | 0.1 | pH = 9 |
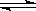 HZ+OH-
HZ+OH-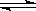 HZ+OH-
HZ+OH-

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.加入NaOH固体 | B.加入冰醋酸 |
| C.增大压强 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用HNO2溶液做导电性实验,灯泡较暗 |
| B.HNO2是共价化合物 |
| C.HNO2溶液不与NaCl反应 |
| D.室温下,0.1mol·L-1 HNO2溶液的pH为2.15 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
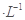 NaOH溶液中逐滴加入。0.2mol
NaOH溶液中逐滴加入。0.2mol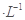 CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是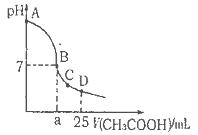
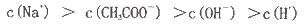
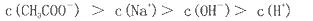
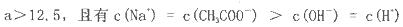
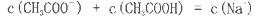
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.混合溶液中由水电离出的c(OH一)=1×10—8mol·L-。 |
| B.c(Na+)=c(X一)+c(HX)=0.2 mol·L- |
| C.c(Na+)一c(X一)=9.9×10-7mol·L- |
| D.c(OH一)一c(HX)=c(H+)=1×lO一6mol·L一 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
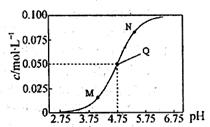
| A.该温度下醋酸的电离常数Ka为l0-4.75mol·L-l |
| B.M点所表示的溶液中: c(Na+)+c(H+)+c(CH3COOH)=0.1 mol·L-1 |
| C.N点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.Q点所表示的溶液中加入等体积的0.05mol·L-1NaOH溶液充分反应后pH>7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 编号 | A | B | C | D |
| 实验 装置 |  |  |  |  |
| 实验 目的 | 实验室模拟侯氏制碱法制备NH4HCO3 | 验证NH3易溶于水 | 制备银氨溶液 | 干燥NH3 |

| 实验步骤 | 实验目的 |
| 步骤1: ①用碱式滴定管取20.00ml 0.1mol/L 的氨水于锥形瓶中,加入几滴 。 ② 。 ③ ,停止滴定,记录数据。重复测定2-3次。 | 测定氨水的准确浓度。 |
| 步骤2: ; | ; |
| 步骤3:通过计算得出氨水的电离常数。 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶质的电离方程式为NaHCO3=Na++ H++ CO32- |
| B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D.温度升高,c(HCO3-)增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com