
电池在生产、生活中应用越来越广泛。下列说法错误的是
A.化学电源有一次电池、可充电电池和燃料电池等,一次电池只能放电,不能充电
B.铅蓄电池应用广泛,主要优点是单位重量的电极材料释放的电能大
C.燃料电池具有能量利用率高、可连续使用和污染轻等优点
D.锂电池是一种高能电池,体积小、重量轻,单位质量能量比高
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
桂醛在食品、医药、化工等方面都有应用。肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
(1)肉桂醛由C、H、O三种元素组成,质谱分析肉桂醛分子的相对分子质量为132,其分子中碳元素的质量分数为81.8%,肉桂醛的分子式是 。
肉桂醛是苯的一取代物,核磁共振氢谱显示,苯环侧链上有三种不同化学环境的
氢原子,其结构简式是 。(不考虑顺反异构与对映异构)
(2)已知:
I.醛与醛能发生反应,原理如下:
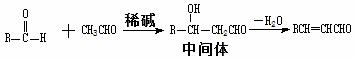
II.合成肉桂醛的工业流程如下图所示,其中甲为某种烃。

①甲的结构简式是 。
②丙和丁生成肉桂的化学方程式是 。
(3)肉桂醛能被银氨溶液氧化,再经酸化得到肉桂酸,写出肉桂酸甲酯的结构简式 。
(4)现用芳香烃A 为原料合成肉桂酸甲酯H的路线如下,测出A的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰2︰1︰2。:

①化合物F中的官能团有 (填名称)。
②B→C的反应类型是 ,F→G的反应类型是 ,
③书写化学方程式
F→I
G→H
④G的同分异构体中,属于酯类目苯环上只有一个取代基的同分异构体有 种。
其结构简式分别是
查看答案和解析>>
科目:高中化学 来源: 题型:
燃煤是影响空气质量的主要原因之一。下列有关叙述错误的是
A.煤主要含碳及少量的氢、氮、硫、氧等元素
B.煤的干馏、液化都是化学变化
C.将煤气化后再燃烧可降低污染
D.生石灰和煤混合燃烧生成CaSO4是减少燃煤产生SO2的唯一方法
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用平衡移动原理解释的是
|
|
|
| |||||||||||||
| A | B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2→2NaNO2 ②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O;

③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
33.写出浓硝酸与木炭反应的化学方程式 。
34.B中观察到的主要现象是 ,D装置的作用是 。
35.检验C中产物有亚硝酸钠的方法是 。
36.经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和 ,为避免产生这些副产物应在B、C装置间增加装置E,画出E并注明E中盛放的药品名称 。
37.写出检验C产物中是否含碳酸钠的方法 。
38.将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H相同
B.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
C.已知:①2H2(g) +O2(g) =2H2O(g) △H=-a kJ·mol-1,②2H2(g)+O2 (g)= 2H2O(1) △H=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2 (g)=CO2(g) △H=- 393.5kJ·mol-1,②C(s,金刚石)+O2(g)=CO2 (g) △H=- 395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) △H= -1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表述正确的是
A.0.1mol·L-1Na2CO3溶液中:[OH-]=[HCO3-]+[H+]+[H2CO3]
B.0.1mol·L-1CH3COONa溶液中:[Na+]=[CH3COO-]+[OH-]
C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:
c (NaOH) <c (Na2CO3) <c(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:
[CH3COO-]>[Na+]>[OH-]=[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
如图各装置不能达到实验目的的是

A.装置①可用于从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
B.装置②可用于干燥、收集氨气,并吸收多余的氨气
C.装置③可用于排空气法收集NO2气体
D.装置④可用于证明Cl2易与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2 NH3(g)+CO2(g)  NH2COONH4(s) + Q (Q > 0 )
NH2COONH4(s) + Q (Q > 0 )
如用右图装置制取氨气,你所选择的试剂是 。
制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化
碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
发生器用冰水冷却的原因是___________ __ _。
液体石蜡鼓泡瓶的作用是__________________________________________________。
从反应后的混合物中分离出产品的实验方法是_______(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空40 ℃以下烘干
 尾气处理装置如右图所示。双通玻璃管的作用:________ ;
尾气处理装置如右图所示。双通玻璃管的作用:________ ;
浓硫酸的作用: 、______________、 _。
取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水
充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量
为1.000 g。则样品中氨基甲酸铵的物质的量分数为___________。
(精确到2位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com