
用NA表示阿伏加德罗常数,下列说法中正确的是
A.足量的Cu与含有0.2mol H2SO4的浓硫酸共热可生成SO2为0.1 NA
B.78 g 苯含有碳碳双键的数目为3NA
C.标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.1NA
D.25℃,1LpH=1的硫酸溶液中含有的H+数目为0.2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:填空题
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:___________________________
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的比值= 。
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
做实验时不小心粘了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:
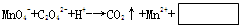
关于此反应的叙述正确的是 ( )
A.该反应的氧化剂是C2O42-
B.该反应右边方框内的产物是OH-
C.该反应中生成1molCO2电子转移数总是5NA
D.配平该反应式后,H+的系数是16
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:推断题
【化学选修2:化学与技术】(15分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:

已知:①NaHSO4溶解度随温度的升高而增大,适当 条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 ,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.向水中通入氯气:Cl2+H2O=2H++Cl-+ClO-
B.向氯化铁溶液中加入铜:2Fe3++3Cu=2Fe+3Cu2+
C.将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
D.镁和稀硝酸反应:Mg+2H+= Mg2++H2↑
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
化学与人类生活、社会可持续发展密切相关。下列有关说法正确的是
①高空臭氧层吸收太阳紫外线,保护地球生物;低空臭氧是污染气体,对人体有危害
②为防止电池中的重金属污染,废旧电池应作深埋处理
③PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重
④易降解的生物农药更适合于在未来有害生物综合治理中的应用
⑤回收制革工厂的边角皮料生产食用明胶,加工成医用胶囊或做食品增稠剂
A.①②⑤ B.①③④ C.②④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步(人教选修4)1.1.1化学反应与能量的变化(解析版) 题型:选择题
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g) CO2(g) ΔH1
CO2(g) ΔH1
C(s)+O2(g) CO(g) ΔH2
CO(g) ΔH2
②S(s)+O2(g) SO2(g) ΔH3
SO2(g) ΔH3
S(g)+O2(g) SO2(g) ΔH4
SO2(g) ΔH4
③H2(g)+O2(g) H2O(l) ΔH5
H2O(l) ΔH5
2H2(g)+O2(g) 2H2O(l) ΔH6
2H2O(l) ΔH6
④CaCO3(s) CaO(s)+CO2(g) ΔH7
CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l) Ca(OH)2(s) ΔH8
Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:选择题
设C+CO2 2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2 2NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为( )
2NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为( )
A.同时增大B.同时减小 C.v1增大,v2减小D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第一章检测试卷(解析版) 题型:实验题
某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.3 ℃ |
|
② | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com