

| 温度(℃) CO2 浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 3×10-3 | 0.9×10-2 | 2.7×10-2 |
| t2 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
| t3 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
分析 (1)图示转化关系中得到在海洋中化石燃料转化为地质碳酸盐的过程中发生的反应类型;
(2)绿色植物通过叶绿体,利用光能,把二氧化碳和水转化成储存能量的有机物,并且释放出氧气的过程,叫做光合作用,绿色植物通过光合作用不断消耗大气中的二氧化碳,维持了生物圈中二氧化碳和氧气的相对平衡;
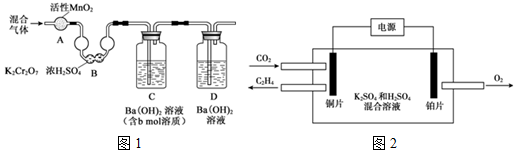
(3)①测定煤或石油的含碳量:将a g的样品进行充分燃烧,测定所得气体(CO2、SO2、NO2、N2)中CO2的含量,过硫酸钠溶液具有氧化性可以优惠二氧化硫为硫酸,氧化一氧化氮为硝酸;
②装置D的作用是防止空气中二氧化碳进入C影响测定气体质量;
③验结束后,还需要向装置中通入N2,把生成的二氧化碳气体全部赶入装置B中完全吸收;
④用x mol/L HCl溶液滴定装置B中过量的Ba(OH)2,消耗y mLHCl溶液,氢氧化钡总量减去被盐酸滴定消耗的物质的量,依据氢氧化钡溶液吸收二氧化碳生成碳酸钡沉淀和水的化学反应的定量关系计算;
(4)①根据v=$\frac{△c}{△t}$计算;
②在一定条件下,对于密闭容器中进行的可逆反应NH2COONH4(s)?2NH3(g)+CO2(g),若达到了平衡状态,各组分的浓度不变,正逆反应速率相等,据此进行判断;
(5)阳极是氢氧根离子失电子生成氧气,在阴极上二氧化碳得电子生成乙烯.
解答 解:(1)图示转化关系中得到在海洋中化石燃料转化为地质碳酸盐的过程中发生的反应类型有:化合反应或氧化反应或裂解反应,
故答案为:化合反应或氧化反应或裂解反应;
(2)绿色植物利用光提供的能量,在叶绿体中合成淀粉等有机物,释放氧气,并且把光能转变成化学能,储存在有机物中的过程,称为光合作用;光合作用的实质是物质转化和能量转化:物质转化是指将无机物转化为有机物的过程,能量转化是指将光能转化为储存在有机物里的化学能的过程,光合作用是把无机物转化为有机物的同时,还能把光能转化为化学能,
故答案为:化学;
(3)①装置混合气体通过A和B的目的是的作用是利用二氧化锰、重铬酸钾和浓硫酸除去SO2、NO2,防止对Ba(OH)2吸收二氧化碳产生干扰,
故答案为:除去SO2、NO2,防止对Ba(OH)2吸收二氧化碳产生干扰;
②装置D的作用是防止空气中的CO2进入装置C,造成测碳量产生误差,
故答案为:防止空气中的CO2进入装置C,造成测碳量产生误差;
③验结束后,还需要向装置中通入N2,其目的是:将装置A中的气体赶入装置B,确保CO2被完全吸收,
故答案为:将装置A中的气体赶入装置B,确保CO2被完全吸收;
④氢氧化钡溶液中含氢氧化钡物质的量为bmol,用来吸收二氧化碳的氢氧化钡物质的量=bmol-$\frac{1}{2}$xy×10-3mol,CO2+Ba(OH)2=BaCO3↓+H2O
二氧化碳物质的量=bmol-$\frac{1}{2}$xy×10-3mol,样品(a g)中碳元素的质量分数=$\frac{(b-\frac{1}{2}xy×1{0}^{-3})×12}{a}$×100%,
故答案为:$\frac{(b-\frac{1}{2}xy×1{0}^{-3})×12}{a}$×100%;
(4)①在25℃,0~t1时间内二氧化碳浓度为3×10-3mol/L,NH2COONH4(s)?2NH3(g)+CO2(g),产生氨气的浓度变化为:2×3×10-3=6×10-3mol/L,则v=$\frac{△c}{△t}$=$\frac{6×1{0}^{-3}mol/L}{{t}_{1}}$=$\frac{6×1{0}^{-3}}{{t}_{1}}$mol/(L•min);
故答案为:$\frac{6×1{0}^{-3}}{{t}_{1}}$mol/(L•min);
②NH2COONH4(s)?2NH3(g)+CO2(g),反应为气体体积增大的反应,
a.反应前后气体物质的量增大,容器内压强不再变化说明反应大多平衡状态,故a正确;
b.容器内 NH3、CO2物质的量比始终为 2:1,不能说明反应大多平衡状态,故b错误;
c.反应前后气体质量变化,容器内气体的质量不再变化说明反应大多平衡状态;
d.速率之比等于化学方程式计量数之比,二氧化碳和氨气速率之比为1:2,生成CO2的速率与消耗NH3速率相等不能说明正逆反应速率相同,故d错误;
故答案为:a c;
(5)铂电极是阳极,溶液中氢氧根离子失电子风扇氧化反应,铜电极为阴极,在阴极上二氧化碳得电子生成乙烯,所以其电极反应式为:2CO2+12H++12e-=CH2=CH2+4H2O,
故答案为:阳;2CO2+12H++12e -═C2H4+4H2O
点评 本题考查了反应速率概念及其计算,化学平衡分析,电极方程式的书写等相关知识的试题,要求考生利用图表、进行数据分析判断,吸收、提取有效信息,突出了化学信息运用能力的考查,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. |  | B. | 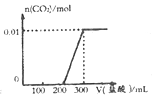 | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入CCl4,CCl4层显紫色,说明原溶液中存在I- | |
| B. | 某溶液中滴加NaOH生成白色沉淀,迅速变成灰绿色,最终变成红褐色,则原溶液有Fe2+,无Fe3+ | |
| C. | 将CO2通入某溶液中,不能产生白色沉淀,说明原溶液中不含Ba2+或Ca2+ | |
| D. | 用干净的铂丝蘸取某溶液在酒精灯外焰上灼烧,火焰呈黄色,说明该溶液中有Na+无K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量 | |
| B. | 436kJ/mol是指断开1molH2 中的H-H键需要放出436kJ的能量 | |
| C. | 431kJ/mol是指生成2molHCl中的H-Cl键需要放出431kJ的能量 | |
| D. | 氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
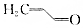 .则与键线式为
.则与键线式为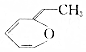 的物质互为同分异构体的是( )
的物质互为同分异构体的是( )| A. |  | B. |  | C. | 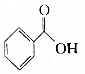 | D. | 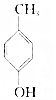 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知CH3OH(l)的燃烧热为238.6 kJ•mol-1,则CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-238.6 kJ•mol-1 | |
| B. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| C. | 反应H2+Cl2═2HCl(△H<0)的机理包含①Cl2-→2Cl(慢),②H2+Cl-→HCl+H(快),③Cl2+H-→HCl+Cl(快),则反应①的活化能小于反应②的活化能 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com