
| >1000K |
| x |
| 2 |
| 5 |
| 2 |
| 5 |
| 2 |
| 1.2mol |
| 2mol |


科目:高中化学 来源: 题型:
| A、4 mol/L |
| B、4 mol/(L?min) |
| C、0.8 mol/L |
| D、0.8 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
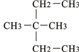 ③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥
③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥37 17 |
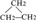 ⑧氯气 ⑨CH3CH2OH ⑩臭氧?
⑧氯气 ⑨CH3CH2OH ⑩臭氧?35 17 |
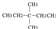 ?CH≡CH?
?CH≡CH?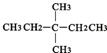 ?H2
?H2查看答案和解析>>
科目:高中化学 来源: 题型:
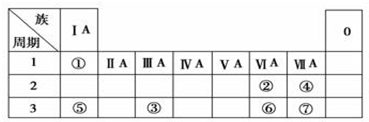
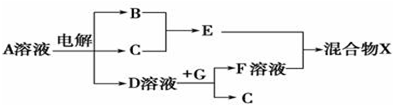
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com