
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
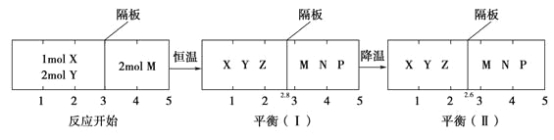
下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(Ⅱ)时,X的转化率为![]()
D.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
【答案】C
【解析】
反应②反应前后物质的量不变,而反应①随着反应的进行正向进行,物质的量减少,隔板向左移动,隔板移动到2.8;降温时,隔板从2.8移动到2.6,物质的量减小,则反应①正向进行,则反应①为放热反应,反应②无法判断。
A. 降温时,隔板从2.8移动到2.6,物质的量减小,则反应①正向进行,则反应①为放热反应,A项错误;
B.相同的温度下,相同的物质的量的条件,压强与体积成反比。反应②反应前后物质的总物质的量不变,反应开始是2mol,所占体积为2体积;平衡(Ⅰ)时,物质的量为2mol,所占体积为5-2.8=2.2体积,有压强之比等于体积之比成反比,有2.2:2=11:10;B项错误;
C.在相同条件下,物质的量之比等于体积之比,平衡(Ⅱ)时,反应①的物质占体积为2.6体积,反应②的物质为2mol,所占体积为2.4体积,则平衡(Ⅱ),反应①的物质的物质的量为![]() mol;平衡利用三等式:
mol;平衡利用三等式:
X(g)+2Y(g)![]() 2Z(g)
2Z(g)
开始反应的物质的量 1 2 0
转化的物质的量 x 2x 2x
平衡(Ⅱ)的物质的量 1-x 2-2x 2x
有3-x=![]() ,则x=
,则x=![]() ,X的转化率为
,X的转化率为![]() ÷1=
÷1=![]() ;
;
C项正确;
D. 平衡(Ⅰ)和平衡(Ⅱ)所处的温度不同,平衡一定发生移动,则M的体积分数一定不相等,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列根据实验操作、现象得出相应结论一定正确的是
选项 | 实验操作、现象 | 实验结论 |
A | 用pH计测定同浓度NaF溶液和CH3COONa溶液: pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
B | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应 FeCl3+3KSCN 的化学平衡逆向移动 |
C | 向盛有2ml0.1mol·L-1AgNO3的试管中滴加5滴0.1mol·L-1NaCl溶液,出现白色沉淀;再往试管中滴加5滴0.1mol·L-1KI溶液,出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
D | 将10mL2mol/L FeCl3的溶液与1mL1mol/LKI溶液混合充分反应后滴加KSCN,溶液颜色变红 | KI与FeCl3反应有可逆性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
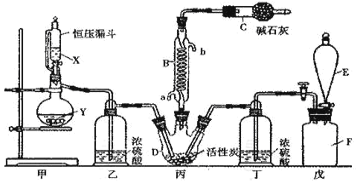
(1)仪器E的名称是_____________,由B的使用可知SO2与氯气之间的反应属于______(填“放”或“吸”)热反应,B处反应管冷却水应从____________ (填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是_______________________________________。
(2)试剂X、Y的组合最好是_________。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为___________ %(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是_______________________________。
Ⅱ.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。
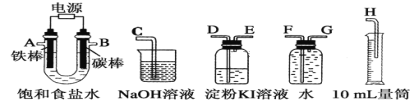
(1)所选仪器接口的连接顺序是A接________,________接________;B接________,________接________。
(2)若装入的饱和食盐水为100mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为112mL(标准状况下)时停止通电。将U形管内的溶液倒入烧杯,常温时测得溶液的pH约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体(K2Cr2O7)和铁红的流程如下:

已知:Ⅰ.2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
Ⅱ.常见离子开始生成沉淀和沉淀完全的pH值如下表所示:
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
(1)铬铁矿反应前需要进行粉碎,目的是________。
(2)熔融Na2CO3条件下主要反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。该反应中的氧化产物为___________、___________。该条件下还可以得到的副产物为NaAlO2和Na2SiO3,写出生成Na2SiO3的化学方程式为__________。
(3)滤渣2的主要成分为____________;滤渣4的主要成分为___________。
(4)调节pH3的合适试剂为_______________;调节pH3的范围为____________。
(5)用醋酸调节pH2=5的目的为________________。
(6)检验滤液4中Fe3+是否沉淀完全的方法是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
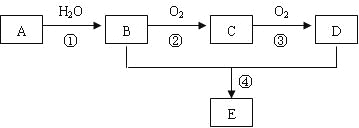
请回答下列问题:
(1)写出A的结构简式___________________________。
(2)B、C分子中的官能团名称分别是________________、______________________。
(3)写出与E具有相同官能团的D的同分异构体的结构简式_______________________。
(4)写出下列反应的化学方程式:
①__________________________________________;反应类型:____________。
④_________________________________________;反应类型:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含![]() 、
、![]() 、
、![]() 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
![]() 第
第![]() 步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
![]() 第
第![]() 步加入
步加入![]() 的作用是 ______ ,使用
的作用是 ______ ,使用![]() 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
![]() 由滤渣2制取
由滤渣2制取![]() ,探究小组设计了三种方案:
,探究小组设计了三种方案:

上述三种方案中, ______ 方案不可行,原因是 ______ ;
![]() 探究小组用滴定法测定
探究小组用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是
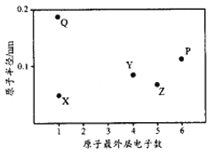
A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王要制备纯净的二氧化碳气体,可供选用的仪器如图所示。可供选用的药品如下:①石灰石②澄清石灰水③稀硫酸④浓硫酸⑤盐酸溶液⑥烧碱溶液⑦蒸馏水。下列装置连接顺序及组合最恰当的是( )

A. A(①⑤)、B(④)、C(⑦)、DB. A(①③)、B(④)、C(⑦)、D
C. A(①⑤)、B(⑦)、C(④)、DD. A(①⑤)、B(⑥)、C(④)、D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com