
| A. | a=2b时,生成沉淀98.5ag | |
| B. | a≤b≤2a时,溶液中含n(NaOH):n(Na2CO3)=(2a-b):(b-a) | |
| C. | 0<b<2a时,沉淀质量随着NaHCO3的加入而不断增加 | |
| D. | b=$\frac{3}{2}$a时,总离子方程式为:3HCO3-+2Ba2++3OH-=2BaCO3↓+CO32-+3H2O |
分析 Ba(OH)2的溶液少量时发生2NaHCO3+Ba(OH)2=BaCO3↓+2H2O+Na2CO3,Ba(OH)2的溶液过量时发生NaHCO3+Ba(OH)2=BaCO3↓+H2O+NaOH,以此来解答.
解答 解:A.NaHCO3,Ba(OH)2的物质的量具体为多少不知,故无法计算沉淀的质量,故A错误;
B.当a≤b≤2a时,NaHCO3+Ba(OH)2=BaCO3↓+H2O+NaOH
1 1 1
a a a
NaHCO3+NaOH=Na2CO3+H2O
1 1 1
b-a b-a b-a
故n(NaOH)=a-( b-a)=2a-b,n(Na2CO3)=b-a,则:n(NaOH):n(Na2CO3)=(2a-b):(b-a),故B正确;
C.当0≤b≤2a时,发生的反应有生NaHCO3+Ba(OH)2=BaCO3↓+H2O+NaOH,2NaHCO3+Ba(OH)2=BaCO3↓+2H2O+Na2CO3,故沉淀质量随着NaHCO3的加入而不断增加,故C正确;
D.当b=$\frac{3}{2}a$时,即b=1.5a,碳酸氢钠和氢氧化钡恰好完全反应生成碳酸钠、碳酸钡沉淀,发生的离子总反应为:3HCO3-+2Ba2++3OH-=2BaCO3↓+CO32-+3H2O,故D正确;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握与量有关的离子反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 | |
| C. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| D. | 将 0.1 mol•L-1NH4A1(SO4)2 溶液与 0.3 mol•L-1Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++40H-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 生成的盐 | 化学式 | 质量/g |
| A | ||
| B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 春节期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.48 L | B. | 5.6 L | C. | 6.7 L | D. | 7.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
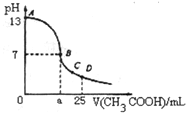 室温下在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,曲线如图所示,有关离子浓度关系比较正确的是( )
室温下在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,曲线如图所示,有关离子浓度关系比较正确的是( )| A. | 在A、B间任意一点,溶液中一定都有c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| B. | 在B点:a>12.5,且有c(Na+)═c(CH3COO-)=c(OH-)═c(H+) | |
| C. | 在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 在D点:c(CH3COO-)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
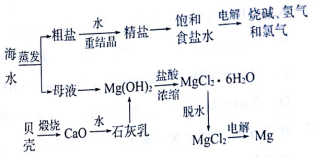
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com