
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 甲基的电子式: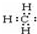 | |
| C. | 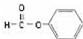 官能团为-COOH 官能团为-COOH | |
| D. | 4-甲基-3-乙基-2-己烯的结构简式为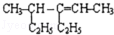 |
分析 A.乙烯的结构简式中漏掉的碳碳双键;
B.甲基为中性原子团,碳原子最外层电子数为7;
C.该有机物为苯甲酸甲酯,其官能团为酯基;
D.该有机物为烯烃,最长碳链含有6个C,碳碳双键在3号C,据此写出其名称.
解答 解:A.乙烯分子中含有碳碳双键,乙烯的结构简式为:CH2=CH2,故A错误;
B.C最外层有4个电子,则甲基中有1个单电子,则甲基的电子式为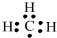 ,故B错误;
,故B错误;
C. 为酯,其官能团为酯基:-COOC-,故C错误;
为酯,其官能团为酯基:-COOC-,故C错误;
D.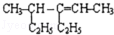 的碳碳双键在3号C,编号从右边开始,在3号C含有个乙基,在4号C含有1个甲基,其名称为:4-甲基-3-乙基-2-己烯,故D正确;
的碳碳双键在3号C,编号从右边开始,在3号C含有个乙基,在4号C含有1个甲基,其名称为:4-甲基-3-乙基-2-己烯,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、官能团、结构简式、有机物命名等知识,明确常见有机物的命名原则为解答关键,试题培养了学生的灵活应用能力.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:填空题
 、
、 、
、 ;比烃A少2个碳原子的同系物有4种同分异构体.
;比烃A少2个碳原子的同系物有4种同分异构体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl 固体和Ba(OH)2晶体在常温下混合即可反应,是因为该反应是放热反应 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热为△H=+566.0kJ/mol | |
| C. | 含1mol Ba(OH)2的溶液和含1molH2SO4的溶液反应放出的热量是中和热 | |
| D. | 1mol CH4燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能是第三周期元素 | B. | Y不可能是第二周期元素 | ||
| C. | Y可能为氢元素 | D. | a-b+m+n等于10或20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石的网状结构中,由共价键形成的碳原子环,其中最小的环上有6个碳原子 | |
| B. | 在氯化钠晶体中,每个Na+或Cl-的周围紧邻6个Cl-或6个Na+ | |
| C. | 干冰晶体熔化时,1mol干冰要断裂2mol碳氧双键 | |
| D. | 在氯化铯晶体中,每个Cs+周围紧邻8个Cl-,每个Cl-周围也紧邻8个Cs+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com