
| A. | 175 | B. | 47 | C. | 118 | D. | 57 |
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:填空题
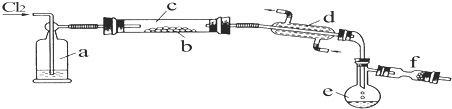
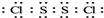 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2•t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素C、D、E的最高价氧化物对应的水化物之间两两都可以发生反应 | |
| B. | 1mol由元素A、B组成且含有18 mol e-的化合物只有一种 | |
| C. | 含D元素的盐溶液只能显酸性,不可能显碱性 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
| C | 室温下,向浓度均为0.1mol•L-1的BaC12和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
| D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存NaClO溶液时加入少量NaOH可以抑制水解 | |
| B. | pH<4时,起漂白作用的Cl2是HClO分解产生的 | |
| C. | 随pH降低,溶液中HClO和Cl2增多,所以漂白速率加快 | |
| D. | 用NaClO溶液漂白色素时,不同条件下由不同成分起到漂白作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com