
【题目】(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
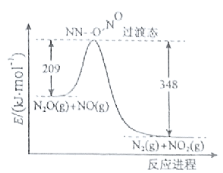
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,△H= kJ·mol-1。
【答案】
(1)NH3·H2O![]() NH4++OH-;降低;增大;
NH4++OH-;降低;增大;
(2)NH4NO3![]() N2O+2H2O;c(N2O)c(H2O)2;4;(3)-139
N2O+2H2O;c(N2O)c(H2O)2;4;(3)-139
【解析】
试题分析:(1)一水合氨为弱碱,在水溶液中存在部分电离,电离出氢氧根离子使溶液显碱性,方程式为:NH3H2ONH4++OH-,向氨水中加入少量NH4Cl固体,铵根浓度增大,平衡左移,即氢氧根浓度减小,pH值降低,加入少量明矾,明矾电离出的铝离子结合氢氧根生成氢氧化铝,促进氨水的电离,铵根浓度增大,故答案为:NH3H2ONH4++OH-;降低;增大;
(2)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3![]() N2O+2H2O,250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4mol,故答案为:NH4NO3
N2O+2H2O,250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4mol,故答案为:NH4NO3![]() N2O+2H2O;K=c(N2O)×c2(H2O);4;
N2O+2H2O;K=c(N2O)×c2(H2O);4;
(3)由图可知,此反应反应物总能量高于生成物,且△H=209-348=-139kJmol-1,故答案为:-139。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH![]() CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H2O![]() CH3COOH+OH- K2=5.71×10-10 △H2>0
CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,则下列叙述正确的是( )
A.对混合溶液进行微热,K1增大、K2减小
B.混合溶液的pH>7
C.温度不变,若在混合溶液中加入少量NaOH固体,则c(CH3COO-)减小
D.混合溶液中c(CH3COO-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一固定容积的密闭容器中加入 1mol A和 2mol B,发生下述反应:A(g)+2B(g) ![]() 3C(g)+2D(s) △H>0。达到平衡时生成了1.8 mol C。
3C(g)+2D(s) △H>0。达到平衡时生成了1.8 mol C。
(1)在相同条件下,若向该容器中改为加入0.3mol A、0.6 mol B,要使平衡混合气体中C物质的体积分数与原平衡的相同,在D足量时,则还应加入 mol的物质C。
(2)若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.8 mol 。则D的起始物质的量n(D)应满足的条件是:n(D)___________。
当改变温度或压强时,有可能改变物质的聚集状态,对平衡产生影响。回答(3)(4)
(3)若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是:_________________;
(4)若将容器改为容积可变的容器,在一定温度和常压下,建立上述平衡之后,A的物质的量浓度为a mol/L。现持续增大压强,当:
①当压强为原来1.5倍时,A的平衡时物质的量浓度为m mol/L,测得m=1.5a;
②当压强为原来10倍时,A的平衡时物质的量浓度为n mol/L,测得n >10 a;
③当压强为原来100倍时,A的平衡时物质的量浓度为p mol/L,测得p<100a。
试解释形成这种结果的可能的原因:
①1.5倍时: ;
②10倍时: ;
③100倍时: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4与氯气发生取代反应,待反应完全后,测定四种有机物的物质的量相等,则产生HCl的物质的量是
A.0.5mol B.2 mol C. 2.5 mol D.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 冰融化时,分子中H—O键发生断裂
B. 原子晶体中,共价键越强,熔点越高
C. 分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定越高
D. 分子晶体中,分子间作用力越大,该物质越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3 ④Al.
A.③④
B.②③④
C.①③④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g).下列说法正确的是( )
Na2S(s)+4H2O(g).下列说法正确的是( )
A.该反应的平衡常数表达式K=c(H2O)/c(H2)
B.若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态
C.若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变
D.若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,将NO2装入带活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )
N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )
A.若体积减小一半,压强增大,V正增大,V逆减小
B.平衡向右移动,混合气体颜色一定会变浅
C.若体积减小一半,压强增大,但小于原来的两倍
D.平衡向右移动,混合气体的平均相对分子量减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com