
| A. | 用Al(OH)3治疗胃酸过多 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用金属铝进行铝热法炼铁 | D. | 用水玻璃制备硅胶和木材防火剂 |
分析 反应中存在元素的化合价变化为氧化还原反应,若不存在元素的化合价变化,则不属于氧化还原反应,以此来解答.
解答 解:A.用Al(OH)3治疗胃酸过多,发生酸碱中和反应,不属于氧化还原反应,故A错误;
B.用熟石灰中和土壤的酸性,发生酸碱中和反应,不属于氧化还原反应,故B错误;
C.用金属铝进行铝热法炼铁,用铝将铁置换出来,属于氧化还原反应,故C正确;
D.用水玻璃制备硅胶和木材防火剂,属于物理变化,与氧化还原反应无关,故D错误.
故选C.
点评 本题考查氧化还原反应,为高考高频考点,侧重于化学与生活、生产的考查,把握发生的化学反应及反应中元素的化合价变化为解答的关键,注意从化合价角度分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| A | 78 | 0.8786 | 80 | A,B,C互溶 |
| B | 74 | 0.81018 | 108 | |
| C | 130 | 0.8670 | 142 |
| A. | 不能用蒸馏的方法进行分离 | |
| B. | 可以用过滤的方法进行分离 | |
| C. | 若采用蒸馏操作,冷凝管中冷却水的流向应该与蒸气的流向相反 | |
| D. | 该实验中用到的玻璃仪器有:酒精灯、蒸溜烧瓶、冷凝管、接液管、锥形瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O与CO2化学性质完全相同 | B. | N2O的电子式可表示: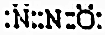 | ||
| C. | N2O与CO2均不含非极性键 | D. | N2O为三角形分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CsICl2常用于化学上的分子筛技术,它既有氧化性又有还原性,CsICl2有还原性是因为有较强还原性的I- | |
| B. | “神舟十一号”宇宙飞船成功与“天宫二号”对接,其太阳能光电池材料是硅 | |
| C. | 司母戊鼎、辽宁舰甲板、超轻钨碳塑钢眼镜框架等原材料属合金 | |
| D. | 硅橡胶能耐高温和耐低温是新型的无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
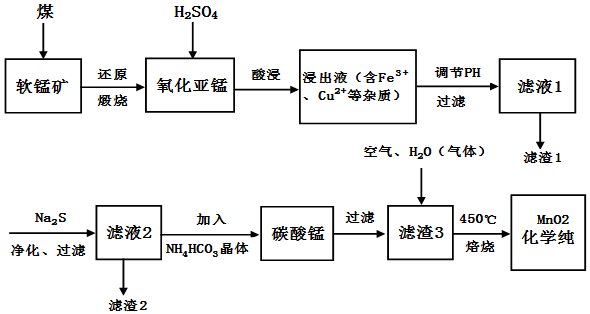
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
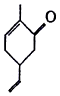
| A. | 可以发生氧化反应 | B. | 分子式为C9H10O | ||
| C. | 分子中所有原子都处于同一平面上 | D. | 能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钙 | B. | 硝酸钾 | C. | 高锰酸钾 | D. | 硝酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
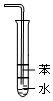 |  | 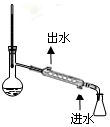 |  |
| A.吸收氨气 | B.中和热的测定 | C.分离溴苯和苯的混合物 | D.除去SO2气体中的HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
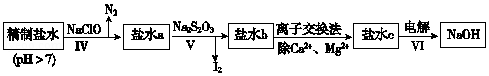
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com