
.利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.
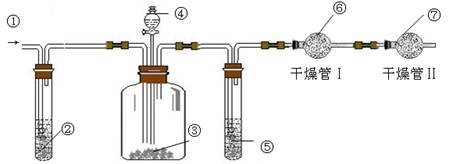
(A) (B) (C)
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复使用),请填写对应的序号:
① 、② 、③ 、④ 、⑤ 、⑥ 、⑦ .
(2)实验中使用了空气,其作用是 ;若通入空气的速度过快或通入空气的量不足,则所测定Na2CO3的含量 (填“偏高”、“偏低”或“准确”).
(3)干燥管Ⅱ的作用是 ,若缺乏干燥管Ⅱ,其后果是 .
(4)若分液漏斗中④的滴液速度过快,将导致实验结果 (填“偏高”、“偏低” 和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量分数的数学表达式为 。
(1)① g ② f ③ d ④b ⑤ a ⑥ e ⑦ e
(2) 使反应产生的CO2气体充分排出;偏低
(3)防止空气中的CO2和H2O被吸入干燥管Ⅰ中。使测出的样品中Na2CO3的质量分数偏大
(4) 偏低
(5)  ×100%.
×100%.
【解析】(1)根据装置图可知,实验原理是利用碳酸钠和酸生成CO2,如果吸收CO2来计算碳酸钠的质量,由于生成的CO2中含有水蒸气,所以在通入碱石灰之前,还需要首先除去水蒸气。又因为装置中会残留CO2,所以还必需通入空气排尽装置的CO2。但其中也含有CO2,所以通入的可知首先要除去CO2,且还必需防止空气中的水蒸气和CO2被碱石灰吸收,所以正确顺序是① g ② f ③ d ④b ⑤ a ⑥ e ⑦ e 。
(2)根据以上分析可知,使用空气的目的是使反应产生的CO2气体充分排出;;若通入空气的速度过快或通入空气的量不足,则生成的CO2不能完全气被吸收,因此结果偏低。
(3)由于空气中也含有水蒸气和CO2,所以干燥管Ⅱ的作用是防止空气中的CO2和H2O被吸入干燥管Ⅰ中;如果没有该装置,则吸收的CO2增加,碳酸钠的质量分数会偏大。
(4)若分液漏斗中④的滴液速度过快,则碳酸钠反应不完全,生成的CO2减少,测定结果偏低。
(5)干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则生成的CO2质量是(m2-m1)g,所以碳酸钠的质量就是(m2-m1)÷44×106,因此质量分数是 ×100%.。
×100%.。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源:2004年高考北京四中全真模拟试卷·化学 题型:058
现有实验药品:一定质量的锌(分片状和粒状两种)、浓H2SO4(密度1.84g·cm-3)、水以及下图装置,图中量气管B是由甲、乙两根玻璃管组成,它们有橡皮管连通,并装适量水,甲管有刻度(0~100mL),甲、乙管可固定在铁架上,供量气用,乙管可上下移动,以调节液面高低,利用此装置可测定锌的相对原子质量.(设锌全部反应,产生的气体不超过50mL)回答下列问题:

(1)实验前为检查装置的气密性,先将A,甲、乙三管固定,乙管中注入水,液面高于甲液面,静置片刻,________________________,说明装置气密性良好.
(2)按图示装置实验,要保证不漏出H2,应如何操作?___________________________.
(3)为了准确地测量H2的体积,在读取反应后甲管中液面的读数时,应注意________(填写序号).
(A)视线与凹液面最低处相平
(B)等待片刻,待乙管液面不再上升时读数
(C)读数时应上、下移动乙管,使甲、乙两管液面相平
(D)读数时不一定使甲、乙两管液面相平
(4)设计一个不用量气管,而用中学常用仪器测量H2体积的装置,应选用的仪器(自选)是_____________________________________________________________________________________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源:全国统一考试能力渗透测试卷——二轮专题检测 题型:058
现有实验药品:一定质量的锌粉(分片状与粒状两种)、浓硫酸(密度为1.84g/![]() )、水以及下图装置,图中量气管B是由甲乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度(0-100mL),甲、乙管可固定在铁架上,供量气用,乙管可上下移动,以调节液面高低,利用此装置可测定锌的相对原子质量。(设锌全部反应,产生的气体不超过50mL)。回答下面问题:
)、水以及下图装置,图中量气管B是由甲乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度(0-100mL),甲、乙管可固定在铁架上,供量气用,乙管可上下移动,以调节液面高低,利用此装置可测定锌的相对原子质量。(设锌全部反应,产生的气体不超过50mL)。回答下面问题:

(1)实验前为检查装置的气密性,先将A、甲、乙三管固定,乙管中注入水,液面高于甲液面,静置片刻,________,说明该装置的气密性良好。
(2)按图示装置实验,要保证不漏出![]() ,应如何操作:________________。
,应如何操作:________________。
(3)为了准确测量![]() 的体积,在读取反应后甲管中液面的读数时,应注意:________。
的体积,在读取反应后甲管中液面的读数时,应注意:________。
(A)视线与凹液面最低处相平
(B)等待片刻,待乙管不再上升时读数
(C)读数时应上下移动乙管,使甲、乙管液面相平
(D)读数时不一定使甲、乙两管液面相平
(4)设计一个不用量气管,而用中学常用仪器测量![]() 体积的装置,应选用的仪器是(自选):________。
体积的装置,应选用的仪器是(自选):________。
查看答案和解析>>
科目:高中化学 来源:2013届山西省山西大学附属中学高三10月月考化学试卷(带解析) 题型:实验题
.利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.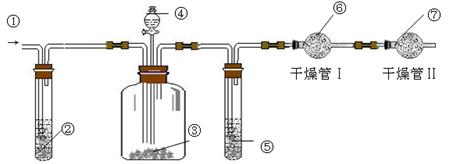
(A) (B) (C)
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复使用),请填写对应的序号:
① 、② 、③ 、④ 、⑤ 、⑥ 、⑦ .
(2)实验中使用了空气,其作用是 ;若通入空气的速度过快或通入空气的量不足,则所测定Na2CO3的含量 (填“偏高”、“偏低”或“准确”).
(3)干燥管Ⅱ的作用是 ,若缺乏干燥管Ⅱ,其后果是 .
(4)若分液漏斗中④的滴液速度过快,将导致实验结果 (填“偏高”、“偏低” 和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量分数的数学表达式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省开封市高三第二次质量检测理综化学试卷(解析版) 题型:实验题
FeSO4·7H2O广泛用于医药和工业领域。
(1)下面是以工业废铁屑为原料生产FeSO4·7H2O的流程图。

请填写下列空白。
①加适量碳酸钠溶液的目的是______________,反应I需要加热数分钟,其原因是___________。
②判断反应Ⅱ完成的现象是__________。反应Ⅱ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制。所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及____________.
③测定FeSO4·7H2O产品中Fe2+含量的方法是用KMnO4溶液滴定法(5Fe2++ +8H+=5Fe3++Mn2++4H2O),步骤为:
+8H+=5Fe3++Mn2++4H2O),步骤为:
Ⅰ.称取2.8500g FeSO4·7H2O产品,配制成250mL溶液;
Ⅱ.量取25.00mL待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.01000moL/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。

某同学设计如图所示的滴定方式中,最合理的是____________(夹持部分略去)(填字母序号);判断此滴定实验达到终点的方法是____________;计算上述样品中FeSO4·7H2O的质量分数为________(用小数表示,保留三位小数);若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有_____________;______________。
(2)已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。

请填写下列空白。
①仪器的连接顺序为a接________、__________接_________、________接__________、__________接_____________。
②装置C中的X为______________;该装置中冷水的作用是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com