
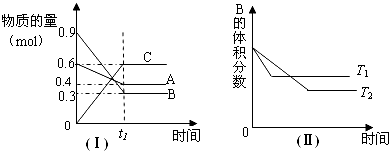
分析 (1)该反应达到平衡状态时,A浓度的变化量=(0.6-0.4)mol/L=0.2mol/L,B浓度的变化量=(0.9-0.3)mol/L=0.6mol/L,C浓度的变化量=(0.6-0)mol/L=0.6mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比;
(2)根据v(A)=$\frac{△c(A)}{t}$计算;
(3)根据“先拐先平数值大”结合图II知,T1>T2;
(4)根据温度对化学平衡的影响分析;
(5)根据A、B、C的浓度结合平衡常数表达式计算.
解答 解:(1)该反应达到平衡状态时,A浓度的变化量=(0.6-0.4)mol/L=0.2mol/L,B浓度的变化量=(0.9-0.3)mol/L=0.6mol/L,C浓度的变化量=(0.6-0)mol/L=0.6mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?3C(g);
故答案为:A(g)+3B(g)?3C(g);
(2)A浓度的变化量=(0.6-0.4)mol/L=0.2mol/L,则v(A)=$\frac{△c(A)}{t}$=$\frac{0.2mol/L}{10min}$=0.02mol/(L•min);
故答案为:0.02mol/(L•min);
(3)“先拐先平数值大”结合图II知,T1>T2;
故答案为:>;
(4)T1>T2,升高温度,B的体积分数增大,即升高温度向逆方向移动,则该反应的正反应是放热反应;
故答案为:放热;
(5)已知A浓度的变化量=(0.6-0.4)mol/L=0.2mol/L,B浓度的变化量=(0.9-0.3)mol/L=0.6mol/L,C浓度的变化量=(0.6-0)mol/L=0.6mol/L,
k=$\frac{{c}^{3}(C)}{c(A)×{c}^{3}(B)}$=$\frac{0.{6}^{3}}{0.2×0.{6}^{3}}$=5;
故答案为:5.
点评 本题考查化学平衡移动以及平衡图象题,做题时注意分析图象中曲线的变化规律,结合外界条件对平衡移动的影响进行分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤 |
| ① | 将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
| ② | 向新制得的Na 2S溶液中滴加新制的氯水 |
| ③ | 将一小块金属钠放入滴有酚酞溶液的冷水中 |
| ④ | 将镁条投入稀盐酸中 |
| ⑤ | 将铝条投入稀盐酸中 |
| ⑥ | 向AlCl 3溶液中滴加NaOH溶液至过量 |
| 实验序号 | 实验步骤(略) | 实验现象 | 化学方程式 |
| ① | |||
| ② | |||
| ③ | |||
| ④ | |||
| ⑤ | |||
| ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下为液体 | B. | 能使酸性KMnO4溶液褪色 | ||
| C. | 可自身加成形成聚乙烯 | D. | 能使溴的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
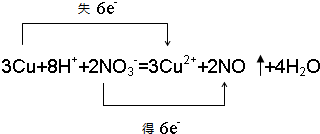 ,在这反应中该强酸展现酸性,氧化性.
,在这反应中该强酸展现酸性,氧化性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
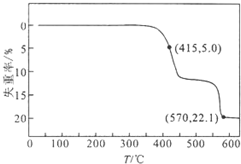 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:| A. | T<415℃,只有反应①发生 | |
| B. | 反应①、②不可能同时发生 | |
| C. | 570℃<T<600℃时,残留固体的主要成分是Na2CO3 | |
| D. | 残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、③的反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | F | |||
| 3 | G | H | I | J | K | L | M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com