
分析 依据盖斯定律和热化学方程式计算得到所需热化学方程式,③+②×2-①×②得到CaCO3与SO2反应生成CaSO4的热化学方程式.
解答 解:①CaO(s)+CO2(g)═CaCO3(s)△H=-178.3kJ/mol
②CaO(s)+SO2(g)═CaSO3(s)△H=-402.0kJ/mol
③2CaSO3(s)+O2(g)═2CaSO4(s)△H=-2314.8kJ/mol
依据盖斯定律计算,③+②×2-①×②得到CaCO3与SO2反应生成CaSO4的热化学方程式:2CaCO3(S)+2SO2(g)+O2(g)=2CaSO4(S)+2CO2(g)△H=-2762.2 kJ/mol,
故答案为:2CaCO3(S)+2SO2(g)+O2(g)=2CaSO4(S)+2CO2(g)△H=-2762.2 kJ/mol.
点评 本题考查了热化学方程式书写方法,盖斯定律的计算应用,主要是热化学方程式书写的注意问题,题目较简单.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na原子最外层有1个电子,易失去,是活泼的金属元素 | |
| B. | Na原子失去1个电子,Al原子能失去3个电子,说明Na的还原性比Al弱 | |
| C. | Na与氧气反应,在不同的条件下生成不同的产物 | |
| D. | Na在空气中会发生变化,要保存在煤油中,以隔绝空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.4g Na2R含Na+0.4mol,则Na2R的摩尔质量为62 g/mol | |
| B. | 同温、同压、同体积的H2和A2气体的质量分别是0.2g和3.2g,则A的相对原子质量为16 | |
| C. | 在标准状况下,CO和CO2混合气体共33.6 L,质量为50g,则两种气体的物质的量之比为1:1 | |
| D. | 浓盐酸的质量分数为36.5%,密度为1.19g•cm-3,则物质的量浓度是11.9 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 会引起白色污染 | B. | 会使水生植物大量繁殖,水质变坏 | ||
| C. | 会使水中形成沉淀堵塞下水管道 | D. | 价格昂贵,使用成本高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘化亚铁溶液中通入少量氯气 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 少量SO2通入次氯酸钙溶液中 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 用氨水吸收过量二氧化硫 NH3•H2O+SO2═NH4++HSO3- | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
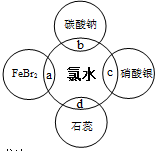 Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题.
Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com