
| A. | 乙烯可用作水果的催熟剂 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | 交警可用酸性重铬酸钾来检测司机是否酒驾 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解MgCl2 溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-73kJ/mol | |
| C. | 将AlCl3溶液与Na2S混合产生沉淀:2Al3++3S2-═Al2S3↓ | |
| D. | 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为0.5akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 应密封保存 | |
| B. | 完全燃烧的反应属于复分解反应 | |
| C. | 可用作燃料 | |
| D. | 其中氮元素与氢元素的质量比为14:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于杀菌、消毒,但不可用来加工食品 | |
| B. | 液氨汽化时要吸收大量热,因此氨常用作制冷剂 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的细小可吸入颗粒物,其分散在空气中能形成气溶胶 | |
| D. | 铝箔在酒精灯上加热铝熔化但不滴落,说明氧化铝的熔点高于铝的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “恶狗酒酸”的成语中涉及了氧化反应 | |
| B. | 饮用的白酒是纯净物,即乙醇 | |
| C. | 酿酒过程中发生了物理变化和化学变化 | |
| D. | 工业酒精中因含有剧毒物质甲醇而不能用来勾兑饮用酒水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| J | ||||
| R |
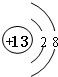 ;元素T周期表中位于第ⅦA族.
;元素T周期表中位于第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的醋酸加水稀释过程中,所有离子浓度都降低 | |
| B. | 电解质在某种状态时可能不导电,非电解质自身一定不导电 | |
| C. | 强电解质溶液中一定不存在电离平衡 | |
| D. | 改变条件使电离平衡正向移动,溶液的导电能力一定增强,电离程度一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a≤b时,发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2CO2═CO32-+HCO3-+H2O | |
| D. | 当$\frac{a}{2}$<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com