
【题目】利用下列反应:![]() 设计一个原电池,请选择适当的材料和试剂。
设计一个原电池,请选择适当的材料和试剂。
I.![]() 请写出你选用的正极材料、负极材料、电解质溶液
请写出你选用的正极材料、负极材料、电解质溶液![]() 写化学式
写化学式![]() :正极为_____________ ,电解质溶液:_____________ ;
:正极为_____________ ,电解质溶液:_____________ ;
![]() 负极反应式: ____________________;
负极反应式: ____________________;
![]() 溶液中
溶液中![]() 向 __________ 极移动。
向 __________ 极移动。
II.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
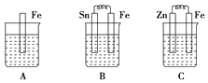
(1)B中Sn极的电极反应式为_________________。
(2)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是_____________________。
【答案】碳棒 FeCl3 Fe-2e-=Fe2+ 正 2H++2e-=H2↑ B>A>C
【解析】
I.在Fe+2Fe3+=3Fe2+反应中,Fe被氧化,应为原电池的负极,电极反应为:Fe-2e-=Fe2+,Fe3+得电子被还原,应为原电池正极反应,正极材料为活泼性比Fe弱的金属或非金属材料,电解质溶液为含Fe3+离子的溶液,如FeCl3,原电池工作时,电子从负极经外电路流向正极,溶液中阳离子向正极移动,阴离子向负极移动,以形成闭合回路。
II. ①根据金属活泼性判断原电池的正负极;根据电极反应式得出正确结论;
②铁的化学性质,能与酸反应;电化学腐蚀的速率大于化学腐蚀的速率,金属作原电池正极时得到保护。
I.(1)在Fe+2Fe3+=3Fe2+反应中,Fe被氧化,应为原电池的负极,电极反应为:Fe-2e-=Fe2+,Fe3+得电子被还原,应为原电池正极反应,正极材料为活泼性比Fe弱的金属或非金属材料如碳棒,电解质溶液为含Fe3+离子的溶液,如FeCl3;
(2)由(1)解答可知,负极反应为Fe-2e-=Fe2+;
(3)原电池工作时,电子从负极经外电路流向正极,溶液中阳离子向正极C 电极方向移动,阴离子向负极移动,以形成闭合回路;
II.(1)铁比锡活泼,锡为原电池正极,电极反应式为:2H++2e-=H2↑;氢离子浓度减小,溶液的pH值增大;
(2)金属活动性Zn>Fe>Sn,B构成原电池,Fe为负极,加快了对Fe的腐蚀速率;C构成原电池,Zn为负极,发生氧化反应,Fe为正极,被保护,C中锌与硫酸反应的离子方程式为:Zn+2H+=Zn2++H2↑,A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁作原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率大于有保护措施的腐蚀,所以A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于组成生物体的化学元素,下列叙述不正确的是
A. 组成生物体的化学元素,可以分成大量元素和微量元素
B. 组成不同生物体的化学元素不仅种类大体相同含量也基本相同
C. 组成生物体的化学元素,没有一种是生物界所特有的
D. 组成玉米和家兔的最基本元素都是碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。
![]() 实验室需要配制0.1 mol·L-1NaOH溶液230mL,请回答下列问题:
实验室需要配制0.1 mol·L-1NaOH溶液230mL,请回答下列问题:
![]() 应选择____mL的容量瓶,用天平称取____g NaOH。
应选择____mL的容量瓶,用天平称取____g NaOH。
![]() 溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度______(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度______。
溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度______(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度______。
![]() 有人认为,用这种方法只能配置0.1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得他的理由是__________________________________________。
有人认为,用这种方法只能配置0.1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得他的理由是__________________________________________。
![]() 选择下列实验方法分离物质,将分离方法的序号填在横线上。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
![]() 萃取分液
萃取分液 ![]() 升华
升华 ![]() 结晶
结晶 ![]() 过滤
过滤 ![]() 蒸馏
蒸馏 ![]() 分液
分液
![]() 分离饱和食盐水与沙子的混合物______;
分离饱和食盐水与沙子的混合物______;
![]() 从硝酸钾和氯化钠的混合液中获得硝酸钾______;
从硝酸钾和氯化钠的混合液中获得硝酸钾______;
![]() 从碘水中提取碘单质______;
从碘水中提取碘单质______;
![]() 分离水和汽油的混合物______;
分离水和汽油的混合物______;
![]() 分离
分离![]() 沸点为
沸点为![]() 和甲苯
和甲苯![]() 沸点为
沸点为![]() 的混合物______。
的混合物______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素是生产生活中常见的非金属元素。
(1)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是________和________。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是__________________
(2)已知:2H2O2(l)===2H2O(l)+O2(g) ΔH1=-196.46 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH2=-285.84 kJ·mol-1
Cl2(g)+H2(g)===2HCl(g) ΔH3=-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式:________________________________。
(3)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
H是一种新型香料的主要成分之一,其合成路线如下所示(部分产物和部分反应条件略去):

已知:①RCH=CH2+CH2===CHR′![]() CH2===CH2+RCH===CHR′;
CH2===CH2+RCH===CHR′;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
请回答下列问题:
(1)(CH3)2CCH2的同分异构体中存在顺反异构的有机物的名称为____。
(2)A的核磁共振氢谱除苯环上的H外,还显示____组峰,峰面积比为___。
(3)D分子含有的含氧官能团的名称是___,E的结构简式为____。
(4)CH2===CH2发生加聚反应的化学方程式为____;D和G反应生成H的化学方程式为____。
(5)G的同分异构体中,同时满足下列条件的有____种(不包括立体异构)。
①苯的二取代物 ②与FeCl3溶液发生显色反应 ③含“—COO—”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3-丁二醇的合成路线。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯锂硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,其工作原理如图所示,电池反应为2Li+nS![]() Li2Sn。下列说法错误的是
Li2Sn。下列说法错误的是

A. 放电时,Li+向正极移动
B. 充电时,A电极连接直流电源的正极
C. 充电时,每生成nmolS,外电路中流过2nmol电子
D. 放电时,正极上可发生反应2Li++Li2S4+2e-=2Li2S2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种饱和一元醇A3.7g,在足量的氧气中完全燃烧后,将所得产物通过足量澄清石灰水时,增重13.3g,若将其先通过浓硫酸,则增重4.5g。若让该物质与足量的钠反应,则可生成标准状况下的氢气0.56L。试求:
(1)A的分子式_____________。
(2)又知该醇在一定条件下发生消去反应时,可生成互为同分异构体的两种烯烃。试写出A的结构简式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2SO4 和Ca(OH)2含有化学键类型相同
B. 水分子很稳定,是因为水分子的分子间作用力强
C. 二氧化碳和乙烯的碳原子的最外电子层都具有8电子稳定结构
D. 冰和水晶都是分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.难溶于水的化合物是非电解质
B.某化合物的水溶液可以导电,所以该化合物是电解质
C.硫酸是电解质,所以硫酸在熔化时或溶于水时都能导电
D.液态氯化氢不能导电,但氯化氢是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com