
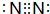 ;构成AlN的微粒是Al原子和N原子.
;构成AlN的微粒是Al原子和N原子.分析 (1)属于非极性分子的为N2,分子中N原子之间形成3对共用电子对;AlN耐高温、酸、碱,抗冲击能力强,属于原子晶体;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)可以根据氢化物稳定性、与氢气反应难易程度、化合物中元素化合价等判断元素金属性强弱,沸点属于物理性质,不能判断非金属性强弱,而氧元素没有含氧酸,不能利用最高价含氧酸的酸性判断;
(4)Al原子核外电子排布式为1s22s22p63s23p1;氢氧化铝存在碱式电离与酸式电离;
(5)固体的质量减少2.80g,根据差量法计算参加反应氮气的质量,根据n=$\frac{m}{M}$计算其物质的量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算v(N2);
(6)a.氮气浓度增大,反应速率加快,而后随反应进行氮气浓度又减小,反应速率减小;
b.混合气体只有氮气与CO,二者相对分子质量均为28;
c.化学平衡常数只受温度影响;
d.增大氮气物质的量,混合气体中氮气含量增大.
解答 解:(1)属于非极性分子的为N2,分子中N原子之间形成3对共用电子对,电子式为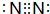 ;AlN耐高温、酸、碱,抗冲击能力强,属于原子晶体,构成微粒为Al原子和N原子,
;AlN耐高温、酸、碱,抗冲击能力强,属于原子晶体,构成微粒为Al原子和N原子,
故答案为: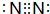 ;Al原子和N原子;
;Al原子和N原子;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Al>C>N>O,
故答案为:Al>C>N>O;
(3)a.沸点不能说明,只能说明水分子间作用力大于氨分子间,故a错误;
b.单质与氢气化合的越容易,元素的非金属性越强,故b正确;
c.氧元素没有含氧酸,不能利用最高价含氧酸的酸性判断元素非金属性强弱,故c错误;
d.NO中O显-2价,N显+2价,说明O原子对键合电子吸引更强,故氧元素非金属性更强,故d正确,
故选:bd;
(4)Al原子核外电子排布式为1s22s22p63s23p1,3p能级的1个电子为单电子,氢氧化铝存在碱式电离与酸式电离,电离方程式为:H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,
故答案为:1;H2O+AlO2-+H+?Al(OH)3?Al3++3OH-;
(5)固体的质量减少了2.80g,则:
Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO 固体质量减少
28 56
x 2.8g
所以x=$\frac{2.8g×28}{56}$=1.4g
氮气物质的量为$\frac{1.4g}{28g/mol}$=0.05mol,
v(N2)=$\frac{\frac{0.05mol}{2L}}{5min}$=0.005mol/(L.min)
故答案为:0.005mol/(L.min);
(6)a.氮气浓度增大,瞬间反应速率加快,而后随反应进行氮气浓度又减小,反应速率又减小,故a正确;
b.混合气体只有氮气与CO,二者相对分子质量均为28,平均相对分子质量为定值28,故b错误;
c.化学平衡常数只受温度影响,与物质的浓度无关,温度不变,平衡常数不变,故c错误;
d.增大氮气物质的量,混合气体中氮气含量增大,平衡时CO与氮气物质的量之比小于原平衡,故d正确,
故选:ad.
点评 本题考查胶体类型与性质、分子极性、元素周期律、核外电子排布、反应速率计算、化学平衡影响因素等,是对学生综合能力的考查,难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质 | B. | 混合物 | C. | 无机物 | D. | 有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 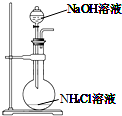 用装置图制取氨气 | B. | 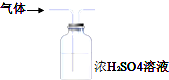 用装置图除去氨气中的水蒸气 | ||
| C. | 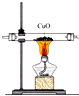 用装置图验证氨气具有还原性 | D. | 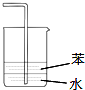 用装置图吸收氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2浓溶液 | B. | NaOH浓溶液 | C. | NH4Cl浓溶液 | D. | MgCl2浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
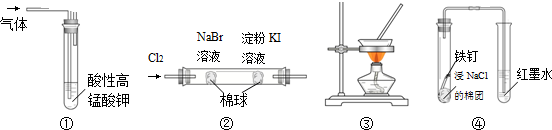
| A. | 图①装置可用于除去甲烷中混有的乙烯 | |
| B. | 图②装置可证明氧化性:Cl2>Br2>I2 | |
| C. | 图③装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 图④装置可观察铁的吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
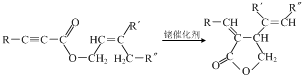
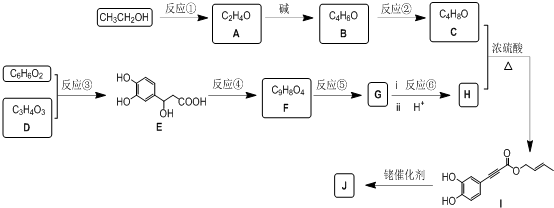
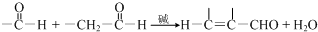
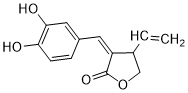
 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 旋转玻璃塞,使漏斗内外气压相等,故液体顺利流下 | |
| B. | 旋转玻璃塞,使玻璃塞贴合更紧密,故液体顺利流下 | |
| C. | 旋转玻璃塞,使漏斗内气压减小,故液体顺利流下 | |
| D. | 旋转玻璃塞,使漏斗颈内污物脱落,故液体顺利流下 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:实验题
(1)配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外还需 和 ;
(2)用托盘天平准确称量 g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待 后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯2-3次,洗涤后的溶液 ,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面 时,改用胶头滴管加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,倒转摇匀,装入细口瓶贴上标签;
(6)下列情况多所配制浓度有何影响? (用偏大、偏小、无影响填写)
A. 所用的固体NaOH长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com